환경유전자 메타바코딩을 활용한 하천 어류 군집 분석
Using eDNA Metabarcoding for the Analysis of Fish Communities in Rivers
Article information
Trans Abstract
The present study aims to assess the effectiveness of eDNA metabarcoding for the analysis of fish communities in rivers. The findings suggest that the methodology attained an accuracy rate of 80% for species identification and was able to detect between 79.2% and 87.5% of the fish species recorded in the fish monitoring database for three rivers of Anseong, Bokha and Gyeongan during the period 2019 to 2021. Significantly, the eDNA metabarcoding technique enabled the successful detection of comparatively larger fish species, such as Channa argus and Silurus asotus. Furthermore, depending on the river, this method identified 12 to 14 additional species that could not be observed through traditional methodologies. However, it is worth noting that the Mifish primer used amplifies short gene segments, which can pose challenges in identifying species with identical gene sequences. Notwithstanding this limitation, the advantages of eDNA analysis over conventional methods are significant, enabling the identification of a broader range of species within a shorter timeframe, using smaller sample volumes and minimizing risks to both endangered fish and to researchers. As a result, eDNA analysis represents a valuable alternative for assessing biodiversity and for collecting data on fish species that are challenging to analyze.
1. 서 론
eDNA (environmental DNA)는 생물체가 물, 토양, 공기 등 주위 환경으로 배출한 유전물질을 말하며, 이를 이용하는 어류 군집조사 (fish community analysis)가 세계적으로 활발하게 연구되고 있다[1]. 어류는 물 환경에서 체액과 조직 세포 (tissue)를 통해서 DNA를 배출하며, 이를 수집하고 분석하면 해당 지역의 특정 어류의 존재 여부, 풍부도 (abundance) 및 다양성 (diversity) 등을 추론할 수 있다[2]. 어류 군집 분석에 eDNA를 사용하면 자망 (gill net), 전기 낚시 (electrofishing), 정치망 (fyke nets), 족대 (kick net), 투망 (casting net) 등을 이용하여 채집하고 전 문지식 (taxonomic expertise)이 필요한 형태적 특징 (morphological characters)을 통해 동정하는 전통적인 방법에 비해 여러 가지 이점이 있다. eDNA 조사법은 비침습적 (non-invasive)으로 환경과 어류 개체군에 최소한의 영향을 미치기 때문에 환경 보전 및 생태조사를 위한 유용한 도구 중의 하나이며[3], 전통적인 방법으로 관찰하기 어려운 종 (rare, elusive, cryptic species)을 탐지할 수도 있다[4]. 또한 전문적인 분류학적 지식이나 시간과 인력을 많이 소모하지 않아도 외래종 또는 멸종 위기 종의 존재를 포함하여 어류 군집에 대한 포괄적인 현황을 살펴볼 수 있다[5]. 이 방법은 하천에서부터 심해 생태계에 이르기까지 다양한 물 환경에서 성공적으로 사용되었으며 어류의 다양성 및 분포에 대한 우리의 이해를 넓힐 수 있는 잠재력도 가지고 있다[6]. 국내에서는 최근 들어 부산 연안[7], 동해[8], 경기도 해양수산자원연구소 생태학습관[9], 황구지천[10], 4개 하천 (금강, 지천, 황지천, 섬진강) [11], 또 다른 4개 하천 (형산강, 태화강, 섬진강, 낙동강) [12] 에 대한 조사 사례가 있지만 아직은 활발하게 수행되고 있지 않다.
본 연구는 경기도 내 3개 하천을 대상으로 어류 군집 분석에 eDNA의 활용 가능성을 검토하였다. 어류는 하천에서는 생태 건강성 평가의 지표로, 호소에서는 생물 다양성 지표로서 활용되고 있으나 지자체 연구기관 등에서 는 전문인력의 부족으로 이러한 조사를 제대로 수행하지 못하는 실정이다. 따라서 이번 연구는 어류 조사에 eDNA 메타바코딩의 유용성을 평가하여 향후 물환경생태 조사에 활용하고자 수행되었다.
2. 재료 및 방법
2.1. 대상
조사 대상은 경기도 해양수산자원연구소 생태학습관 (경기도 양평군 용문면) 및 환경부 생물측정망 지점인 안성천1 (안성시 현수동, 안성교), 복하천1-1 (이천시 갈산동, 복하2교), 경안천5 (광주시 초월읍 무갑리, 서하교)를 선정하였고 (Fig. 1), 하천수 시료는 생물측정망 (2019~2021) 가을철 자료와 비교하고자 9~10월에 채취하여 분석하였다.
2.2. 실험방법
2.2.1. Primer 정확성 및 실험조건 확인
본 연구에서는 eDNA 분석법을 하천에 적용하기 전에 실험조건 및 적용 가능성을 확인하기 위해 경기도 해양수산자원연구소에서 운영하는 민물고기 생태학습관에서 임의로 선정한 하나의 종이 서식하는 수조 20곳에서 시료 200 mL를 각각 채취하였다. 실험실 이동 후 채취한 20개 시료는 같은 양으로 혼합한 후 0.45-μm Micro Funnel filter (Pall Life Science, Puerto Rico)로 여과하고 DNeasy PowerWater kit (Qiagen, Hiden, Germany) 를 이용해 eDNA를 추출하였다. 추출한 eDNA의 어류 메타바코딩 (metabarcoding)은 미토콘드리아 12S rRNA 유전자의 변이가 많은 영역 (hypervariable region)을 대상으로 하는 Mifish U-F와 Mifish U-R primer [14]와 Illumina MiSeq platform를 이용하여 분석을 수행하였다 (Macrogen, Seoul).
2.2.2. 하천 시료 적용
하천 시료는 멸균한 용기를 이용해 다리 위에서 채취하고 50-mL 일회용 주사기와 0.45-μm Sterivex filter (Merck Millipore, Darmstadt, Germany)를 이용해 현장에서 ~ 500 mL 정도를 여과한 후 드라이아이스를 이용해 저온 보관 운반하여 메타바코팅 분석을 수행하였다 (NICEM. Seoul). eDNA 추출은 DNeasy Blood & Tissue kit (Qiagen, Hiden, Germany)를 이용하였으며 나머지는 앞서의 과정과 같다. 메타바코딩으로부터 얻어진 FASTA 파일은 Mifish pipeline [15]을 이용하여 primer 서열과 품질이 낮은 서열 제거를 통해 97% 이상의 유사성 (similarity)을 가진 서열들을 MOTUs (molecular operational taxo-nomic units)로 선정하고 Blastn을 통해 NCBI (national center for biotechnology information)의 데이터베이스 (GenBank)와 비교하여 같은 유사도를 가진 2개 이상이 얻어지면 국내 서식 어종으로 동정하였다. eDNA와 전통적인 방법에 의한 어류 군집 조사 결과와 비교하기 위해 환경부 물환경정보시스템의 2019~2021년 2차 조사 (가을철)에 한번 이상 채집된 어종과 이번 연구에서 eDNA에서 동정된 어종을 표에 함께 나타내었다. 또한 전통적인 방법에 의해 채집된 각 어류 종의 개체 수와 eDNA 메타바코딩을 통해 얻어진 read의 개수를 이용해 다양성 지수 (H`, Shannon’s diversity index)와 균등도 지수 (E, Pielou’s evenness index)를 다음과 같이 계산하여 비교하였다.
여기서, Pi = ni/N (ni = 한 종의 개체수, N = 모든 종의 총 개체수)
여기서, H` = 다양성 지수, Hmax = ln S (S = 발견된 종 수)
3. 결과 및 고찰
3.1. Mifish primer의 성능
본 연구에서는 Mifish primer를 이용하여 경기도 해양수산자원연구소 생태학습관에서 임의로 선정한 20개 대상 어종 중에서 16개 종이 확인되어 80%가 검출 가능하였다 (Table 1). 이러한 검출율은 앞서 진행된 연구[9]의 90% 보다 낮았으며 몇 가지 원인을 고려할 수 있으나[16-18] eDNA를 추출하기 위해 사용된 kit의 차이 때문으로 추정된다. 이전 연구에서 어떤 종류의 kit가 사용되었는지 제시되지 않았지만 이번 연구에서는 하천 시료 eDNA 추출에 DNeasy PowerWater kit (PW)를 사용한 경우 3번 연속 메타바코딩 분석이 제대로 진행되지 않았지만 DNeasy Blood & Tissue kit (BT)를 이용한 경우에는 적절한 결과를 얻을 수 있었다. 또한 생태학습관 시료에서 검출하지 못한 Tanakia koreensis (칼납자루) [9], Coreoperca herzi (꺽지) 는 다른 연구에서는 Mifish primer에 의해 검출되는 것으로 나타났고 [16] Koreocobitis rotundicaudata (새코미꾸리)는 경안천에서 Rhodeus notatus (떡납줄갱이)는 안성천과 복하천에서 각각 검출되었다. eDNA를 이용한 어류 군집연구에는 BT와 PW kit가 좋은 품질의 eDNA를 얻을 수 있어서 많이 사용되며 [19] DNA extraction kit가 eDNA 메타바코딩에 미치는 영향에 관한 연구에서도 BT kit와 phenol/chloroform extraction 방법을 함께 적용하여 가장 좋은 결과를 얻었으며[20], 이번 연구에서도 조건과 목적에 맞게 DNA extraction kit를 선택해야 한다는 것을 보여주었다[18].
3.2. 하천시료의 적용성
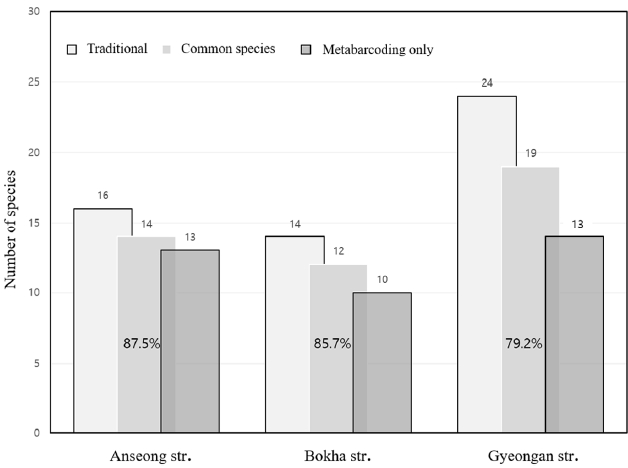
eDNA를 이용한 본 연구와 전통적인 방법의 환경부 생물측정망 (2019~2021년)의 2차(가을철) 결과와 비교하였고 3년 중에서 한번이라도 관찰된 어류를 대상으로 하였다 (Table 2). 표에는 NCBI 유전자 서열분석에서 같은 유사도(%)의 국내 서식 어종이 2개 이상이 일치하면 모두 표시하였다. 예를 들어 Acheilognathus rhombeus/A. gracilis (납지리/가시납지리), Hemibarbus maculatus/Hemi-barbus labeo (알락누치/누치), Tridentiger obscurus/Tridentiger brevispinis (검정망둑/민물검정망둑), Acheilo-gnathus macropterus/A. chankaensis (큰납지리/가시납지리), Oryzias sinensis/Oryzias latipes (대륙송사리/송사리)등은 Mifish primer에 의해 증폭된 미토콘드리아 12SrRNA 유전자 염기서열로는 구분할 수 없기 때문에 속 (genus) 수준에서만 동정이 가능하였다. 이 가운데에서 검정망둑/민물검정망둑은 일부 성체를 제외하고는 분류학 적동정 형질 (taxonomic keys)이 명확하게 나타나지 않아 육안으로도 분류하기 매우 어려운 근연종이다. 2019 ~ 2021년 생물측정망에 따르면 3개 하천에서의 출현종 수는 안성천 12 ~ 14종, 복하천 8 ~ 11종, 경안천 12 ~ 16종으로 이번 연구의 eDNA 분석 방법을 통해 검출된 어종의 1/2 수준이었다. 안성천에서는 전통적인 방법으로 3과 (family) 16종 (species) 관찰되었으며 eDNA에서는 이 중에서 14종이 확인되었고 (14/16, 87.5%), 13종이 새롭게 검출되었다. 복하천의 경우, 생물측정망에서 4과 14종이 출현하였으며 12종이 eDNA 분석에서 공통적으로 동정되었고 (12/14, 85.7%) 10종의 새로운 어류 종이 검출되었다. 경안천에서는 전통적인 방법으로 2과 24종이 eDNA 분석으로는 11과 32종이 동정되었고 이 중에서 19종 (19/24, 79.2%)은 공통적으로 확인되었으며 13종이 새롭게 검출되어 기존 연구[10]의 35~45%에 비해서 월등히 높았다. 따라서 두 방법을 통해 안성천 29종, 복하천 25종, 경안천 37종으로 3개 하천에서 총 47종의 어류가 확인되었다 (Fig. 2). 이 가운데에서 Acheilognathus rhombeus (납지리), Carassius auratus (붕어), Cyprinus carpio (잉어), Micro-physogobio yaluensis (돌마자), Odontobutis interrupta (얼록동사리), Pseudogobio esocinus (모래무지), Pseudoras-bora parva (참붕어), Rhinogobius sp. (밀어), Zacco platypus (피라미)와 같은 7종은 3개 하천에서 두 방법 모두에서 관찰되었다. 또한 야행성으로 전통적인 방법으로 관찰하기 어렵다고 알려진 Anguilla japonica (뱀장어) [21]는 2개 하천에서, 또한 국내 수계에서 흔히 서식하는 1급수 지표 어종인 Rhynchocypris oxycephalus (버들치), Misgurnus anguillicaudatus (미꾸리), 대형 어종인 Channa argus (가물치)와 Silurus asotus (메기)는 3개 하천에서 eDNA 분석에서만 검출되었다.
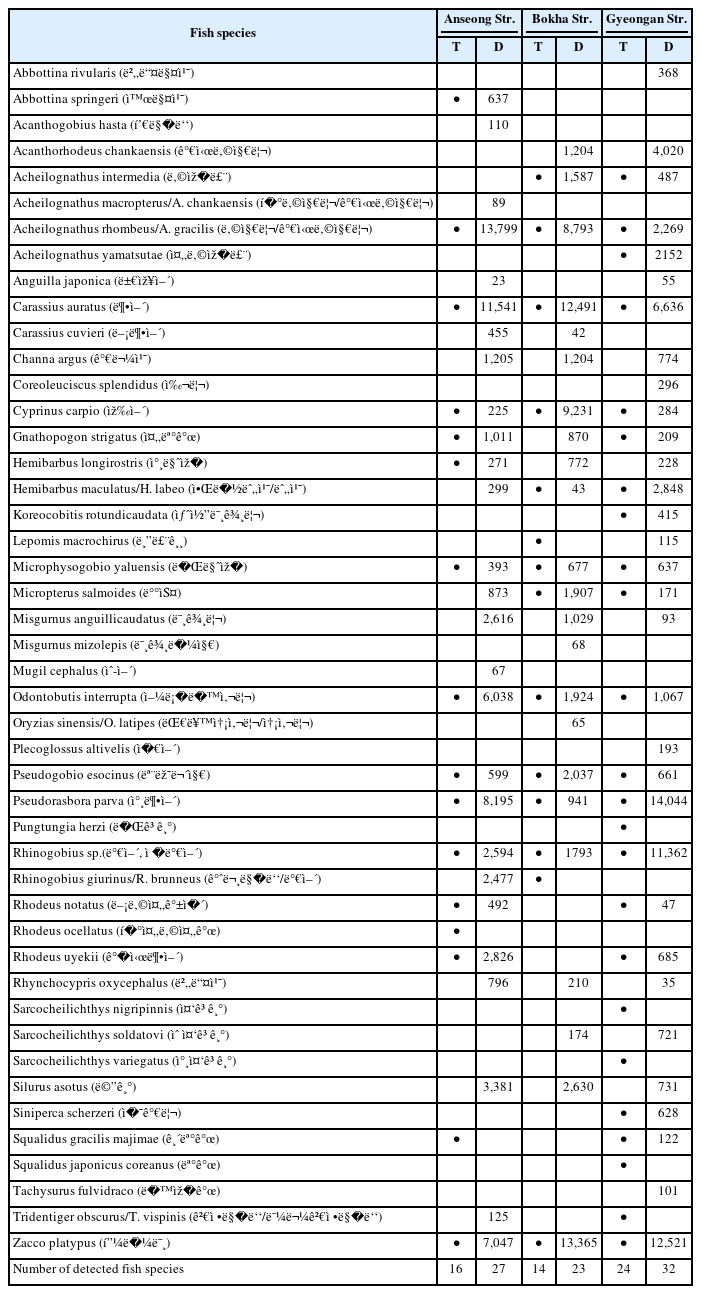
Comparison of fish species detection in three rivers using traditional method (T, 2019~2021) and eDNA metabarcoding (D)
생물측정망에 따르면 3개 하천 모두에서 Zacco platypus (피라미)가 점유율 39.7 ~ 52.4%로 절대적으로 많이 관찰되었고 eDNA 분석에서도 10.3 ~ 21.2%로 두 방법 모두에서 우점종의 하나로 나타났다. 안성천에서는 Pseudoras-bora parva (참붕어), Rhodeus uyekii (각시붕어), Rhodeus ocellatus (흰줄납줄개)가 상대적으로 많이 관찰되었고 eDNA에서는 Acheilognathus rhombeus (납지리), Carassius auratus (붕어), Pseudorasbora parva (참붕어)의 read 수가 피라미보다 많았다. 복하천에서는 Pseudogobio esocinus (모래무지)가 피라미의 뒤를 이었는데 eDNA에서는 Carassius auratus (붕어), Cyprinus carpio (잉어), Acheilognathus rhombeus (납지리) 등이 상대적으로 많았다. 경안천에서는 피라미 이외에 Pungtungia herzi (돌고기), Rhinogobius sp. (밀어), Rhodeus uyekii (각시붕어) 가 많이 관찰되었으며 eDNA에서는 Pseudorasbora parva (참붕어), Rhinogobius sp. (밀어) 등이 많이 확인되었다.
eDNA 분석에서 검출된 read 수와 생물측정망 자료를 이용해서 풍부도 (richness), 다양성 (Shannon diversity index) 지수를 산출하여 나타냈으며 생물측정망 자료는 3년 평균이다 (Table 3). 관찰된 개체수는 83~174로 차이가 크나 eDNA 메타바코딩에 의한 read 수는 63,057~68,145로 크지 않았다. eDNA 분석법에서 전통적인 방법에 비해 풍부도는 2배 이상, 다양성 지수는 1.507~1.901 vs 2.357~2.509로 더 크며 관찰된 총 개체수가 적은 복하천에서 두 방법의 차이가 가장 컸다. 다양성 지수는 풍부도와 균등도를 결합한 지수로 값이 클수록 다양성이 커진다는 것을 의미하며 두 방법이 차이가 나는 이유는 eDNA 분석법이 더 많은 수의 어류 종을 검출하기 때문이다. 균등도 지수는 군집 내 종 구성의 균일한 정도를 나타내는 지수이며 두 방법을 통해 얻은 결과는 안성천(0.748 vs 0.761)에서는 비슷하나 복하천(0.664 vs 0.752)과 경안천(0.731 vs 0.694)에서는 차이가 컸다. eDNA의 농도가 어류의 다양성 및 생체량과 양의 상관관계가 있다는 다수의 연구가 있으나[22] 부정적인 연구결과 또한 존재한다[23]. 이번 조사에서도 전통적인 방법에 따른 우점 어종 (39.7~52.4%) Zacco platypus (피라미)가 메타바코딩 read 수도 많았으나 (안성천: 10.3%, 복하천: 21.2%, 경안천: 19.3%), 안성천에서는 Carassius auratus (붕어, 16.9%)와 Pseudorasbora parva (참붕어, 12.0%)의 read 수가 더 많았고, 복하천에서는 Carassius auratus (붕어, 19.8%)와 Cyprinus carpio (잉어, 14.6%)가 비교적 많이 검출되었고, 경안천에서는 Pseudorasbora parva (참붕어, 21.6%)의 read 수 비율이 더 높았다. 따라서 전통적인 방법에 의한 개체수와 메타바코딩에 의한 read 수의 상관관계는 입증할 수 없었다. 다만 상대적인 비교[24]를 위해 반정량적 (semi-quantitative)으로 이용할 수 있으며 read 수의 상대적 비율을 이용하여 풍부한 (abundant) 종과 희귀한 (rare) 종을 구분하거나[5] 하천 생태계 보전을 위한 관리대책 수립에도 유용하게 사용될 수 있을 것이다[25]. 현재 국내 하천의 어류조사에서는 대부분 투망과 족대가 활용되고 있으며 이러한 전통적인 방법도 채집이나 동정 과정에서 발생할 수 있는 편차 (bias)로 인한 정량적 분석에는 한계가 있다[26]. 실제로 안성천, 복하천, 경안천의 어류 군집조사에서 채집된 개체수가 3년 동안 83~174로 많지 않기 때문에 개체수가 적은 희귀한 종의 경우에는 관찰하기 어려울 것으로 예상되며 동정에서도 오류가 발생할 가능성 또한 상존한다. 이러한 결과로 볼 때 eDNA를 적절하게 활용한다면 전통적인 방법에서 놓치는 어류를 현장에서의 짧은 채수시간 및 적은 시료량으로 분석이 가능하며, 79% 이상 같은 어종이 검출되어서 하천의 어류 군집 분석에 전통적인 방법과 함께 활용할 수 있을 것으로 판단된다.
4. 결 론
본 연구에서는 하천 어류 군집 분석을 위해 eDNA를 이용한 분자생물학적 기법을 적용하였다. eDNA 메타바코딩은 민물고기 생태학습관 시료에 대해 80%의 정확성을 보였다. 또한 하천의 어류 생물측정망에서 과거(2019 ~ 2021)에 관찰되었던 어종의 79.2 ~ 87.5%를 검출하여 하천 어류 군집 분석에 eDNA 활용 가능성을 보여주었다. 한계점으로는 Mifish primer가 증폭하는 유전자 부분이 163 ~ 185bp로 짧아서 같은 유전자 염기서열을 갖는종이나 우리나라 고유종[11]의 경우에 구분이 어렵기 때문에 특정한 종들의 정확한 동정을 위해서는 보완적인 primer의 개발도 필요하다. 예를 들어 Mifish-tuna primer는 Thunnus (다랑어 속)에 속하는 7종을 검출하기 위해 개발되었고[14], 다른 유전자를 대상으로 하는 primer를 조합하여 사용하면 더 많은 어종을 검출할 수 있었다[27]. 또한 가물치, 메기 등 국내에 서식하지만 전통적인 채집 방법으로 확인하지 못했던 대형 어종도 이번 eDNA 분석에서는 검출되었기 때문에 두 방법의 상호 보완 활용도 필요하다. eDNA 분석은 현장에서 특별한 장비 없이 짧은 시간(~10분)과 적은 시료량 (300 ~ 500 mL)으로 전통적인 채집 방법보다 많은 종류의 어류 검출이 가능했다. 또한 현장 조사 과정의 위험성, 조사 과정 중의 멸종위기 어류 폐사, 조사자의 숙련도에 따른 오차를 감소시킬 수 있어서 몇 가지 한계점에도 불구하고 보완적이고 대안적인 접근 방식으로 활용될 수 있을 것이다. 본 연구에서 분석하기 어려웠던 우리나라 고유종 등 특정한 어류 종에 대한 유전자 데이터를 축적하고 적절한 실험법을 적용한다면, 적은 노력으로 장기적으로 더 정확한 생물다양성 자료를 확보할 수 있을 것으로 기대된다.
Acknowledgements
본 논문은 환경부의 재원으로 국립환경과학원의 지원을 받아 수행하였습니다 (NIER-2022-01-03-014).