Portable Composite Sampler 및 LC-HRMS를 이용한 하폐수처리장 인근 하천수 내 미량오염물질 분석 및 시간경과에 따른 농도 변화
Analysis and Change in Concentration of Micropollutants in Stream Affected by WWTP Effluents using Portable Composite Sampler and LC-HRMS
Article information
Trans Abstract
With the increase of manufacturing and use of chemicals, an increasing amount of chemicals enters surface water through various pathways. Their concentrations range from ng/L to mg/L, and they are recognized as micropollutants that pose potential risks to human health and aquatic ecosystems. This study quantitatively analyzed the diverse micropollutants in a stream affected by effluents from a waste-water treatment plant (WWTP) and demonstrated the changes in concentration over time. To capture temporal trends, water samples were collected using a portable composite sampler. For a comprehensive chemical analysis of the 148 species, target screening was conducted using liquid chromatography with high resolution mass spectrometer (LC-HRMS). As a result of the quantitative analysis, a total of 71 substances were detected at concentrations higher than the limit of quantification (LOQ). Pharmaceuticals accounted for the highest proportion among the detected substances. Tris (2-butoxyethyl) phosphate (tbep), which is used as an organophosphate flame retardant (OPFRs), was detected as a major pollutant at a maximum of 14,000 ng/L. Metformin, Pentaethylene glycol, cetirizine, galaxolidone, acetaminophen, heptaethylene glycol, carbamazepine-10,11-epoxide, sulfapyridine, valsartan acid, telmisartan, fluconazole, benzotriazole, olmesartan, 4-Methyl-1H-benzotriazole, sitagliptin, and perfluorohexanoic acid (PFHxA) were detected at concentrations of 1,000 ng/L or higher. As a unique temporal trend in the concentration, per-and polyfluoroalkyl substances (PFAS) and benzotriazoles exhibited the highest concentrations from 00:30 to 02:00 on 5/10 with a gradual decrease thereafter. The main factor responsible for this change in concentration was the effluent from the WWTP located upstream of the sampling point. In addition, the substance used in a nearby large-scale industrial complex is considered a significant factor.
1. 서 론
기술의 발전과 인구 및 산업 활동의 증가에 따라 수많은 화학물질이 제조 및 생산되고 있으며 현재 European Chemicals Agency (ECHA)에 등록된 화학물질의 수는 약 22만종에 이른다. 화학물질의 사용량이 증가함에 따라 다양한 경로를 통해 지표수, 대기 및 토양 등의 환경으로 배출되고 있다. 지표수 내 배출된 미량오염물질은 ng/L ~ mg/L의 농도 범위로 존재하고, 의약품, 농약, 산업용제 등의 다양한 화학물질을 포함한다. 지표수 내 존재하는 미량오염물질의 경우 물리적, 화학적, 생물학적 변환과정을 통해 대사체 (Transformation product, TPs)를 형성하기도 하며, 이는 새로운 환경오염원으로 알려져 있다. 지표수 내 미량오염물질의 주요 배출원은 하폐수처리장으로 알려져 있다[1,2,3,4]. 하폐수처리장의 일반적인 처리방식 (e.g., 생물학적처리 등)으로는 친수성 및 난분해성 특성을 지니는 대부분의 의약품, 농약 및 산업용제와 같은 유기화학물질을 부분적으로 처리하거나 처리하지 못한 채 지표수 내로 방류되고 있다[5]. 지표수로 유입된 미량오염물질은 미량의 수준일지라도 장기간 노출 시, 인간의 건강 및 수생태계에 부정적인 영향을 미칠 수 있어 꾸준한 모니터링 및 저감대책이 필요한 실정이다.
지표수 내 존재하는 미량오염물질 분석을 위한 시료 채취 방식은 시료의 특성에 따라 달리 이뤄지며, 일반적으로 spot sampling이라고 불리는 manual grab sampling 의 경우, 특정 샘플링 위치 및 시간 또는 샘플링 위치 내 특정 정보 등을 원할 때 활용된다. 하지만 화학사고와 같은 접근이 어려운 경우 또는 대량의 시료가 필요한 경우에는 manual grab sampling으로 분석을 진행하기에는 많은 한계가 있다. 이를 대체하기 위하여 composite sampler 및 passive sampler 등의 다양한 채취 방법이 발전되어 왔다[6,7,8]. 특히, composite sampler는 샘플링 기간동안 일정한 간격에 걸쳐 시료 채취가 이루어지며, 시간 경과에 따른 시료의 농도 및 경향을 파악할 수 있다. 실제 지표 수는 다양한 점오염원 및 비점오염원에 의한 유입으로 시간경과에 따른 농도 변화가 크다고 판단된다. 하폐수처리장 인근에 위치한 하천의 경우, 하폐수처리장 방류시간이 미량오염물질 농도 변화에 유의미한 영향을 미쳤을 것이라 보여지며, portable composite sampler를 활용하여 지표수 내 존재하는 미량오염물질의 시간에 따른 농도 변화 및 경향성을 모니터링할 필요가 있다.
미량오염물질분석에 활용된 고성능 액체크로마토그래피와 고분해능 질량분석기 (Liquid Chromatography High Resolution Mass Spectrometry, LC-HRMS)는 광범위한 유기오염물질을 식별하는데 최적화된 것으로 알려져 있어 정밀한 분석을 요구하는 환경 시료 내 미량오염물질 분석에 용이하다[9,10,11,12,13,14]. ESI (Electrospray ionization) 소스를 이용한 이온화 방법은 친수성이 강한 의약품, 농약 등의 미량오염물질에 대한 높은 이온화 효율을 보여준다[15]. 고분해능질량분석기를 활용한 분석은 낮은 mass error와 높은 민감도를 기반으로 신호정보를 인지하여 많은 미량오염물질에 대하여 보다 정확한 동시분석이 가능하다.
본 연구에서는 portable composite sampler를 이용하여 시료 채취를 진행한 후, LC-HRMS를 이용한 정량분석을 통해 하폐수처리장 인근 지표수 내 존재하는 미량오염물질의 분포 및 농도를 확인하고자 한다. 이와 함께, 시간 경과에 따른 일부 미량오염물질 그룹의 농도 변화 및 경향성을 파악하고자 한다.
2. 재료 및 방법
2.1. 시료채취
시료채취는 2022년 5월 9일과 10일 이틀에 걸쳐 대구광역시에 위치한 진천천 인근 구라 2교에서 이루어졌으며, Portable composite sampler (HACH, USA)를 통해 일정한 시간 간격을 두고 총 21회 수행되었다 (Fig. 1). 해당 지점은 인근에 서부하수종말처리장과 성서산업단지 관리공단이 위치해 있어 하폐수 방류수의 직접적인 영향을 받고 있고, 의약품 및 개인관리 용품 뿐만 아니라 산업단지에서 사용되는 다양한 화학물질이 검출되고 높은 농도로 정량된 것으로 나타난다[16]. 채취된 시료는 아이스박스에 담겨 실험실로 옮긴 후, 전처리 전까지 4oC 이하에서 냉장 보관하였다
2.2. 분석 대상물질 선정 및 표준시약
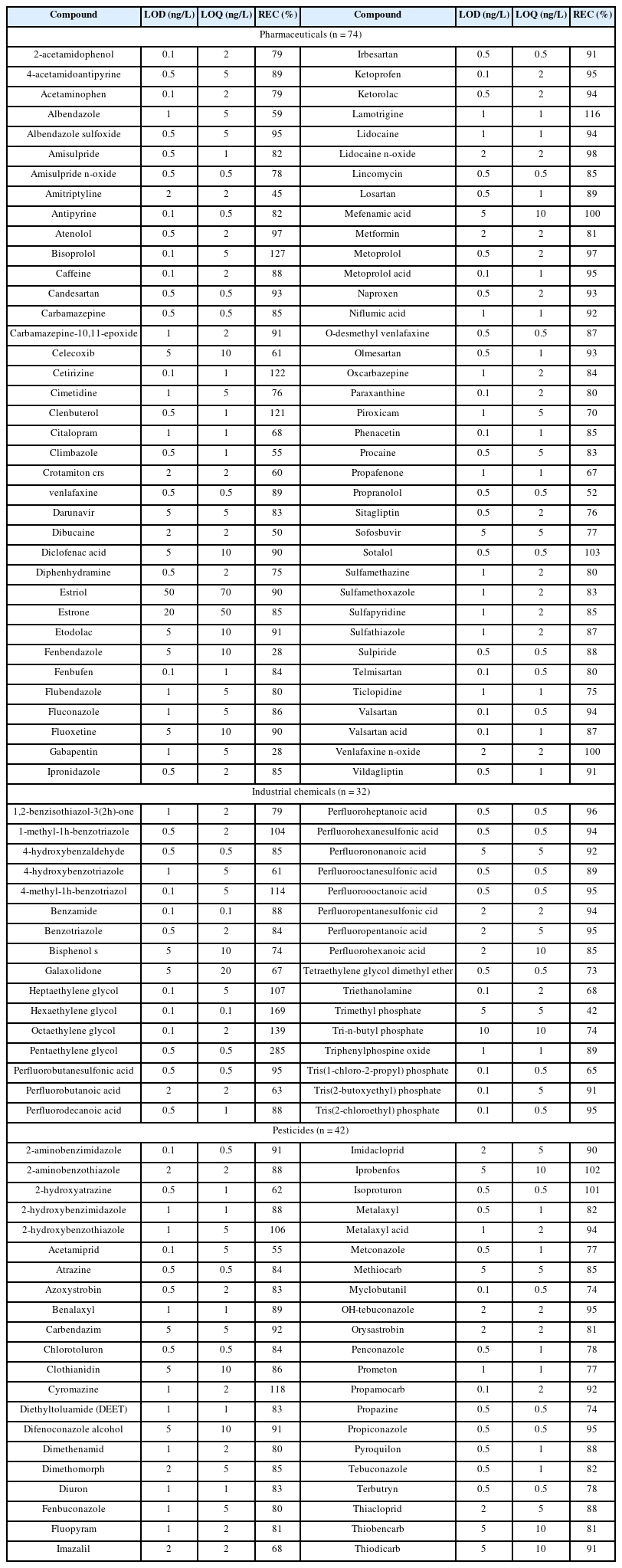
연구실 내 보유한 낙동강 지역의 장기 데이터베이스를 통해 검출이 예상되는 148종을 분석 대상물질로 선정하였다. 대상물질은 의약품 74종, 산업용제 및 기타 42종, 농약 32종으로 구분되었다. 표준용액 제조를 위한 표준물질과 내부표준물질은 모두 순도 95% 이상의 초고순도 물질을 Sigma-Aldrich (Missouri, USA), Toronto Research Chemicals(North York, Canada), Wellington Laboratories (Ontario, Canada), J.T. baker(New Jersey, USA) 및 Fisher Scientific (Pittsburgh, USA)에서 구입하여 사용하였다. 분석에 사용된 표준물질 및 내부표준문질의 구매정보는 Table 1에 표기하였다. 에탄올에 용해된 표준용액 (500 또는 1,000 mg/L)은 분석 전까지 −20oC 어두운 곳에서 보관하였다.
2.3. 시료 전처리
시료의 전처리 방법은 고상 추출법 (Solid phase extraction; SPE)을 적용하였다. 1 L 시료를 Glass microfiber filter (GF5; 0.45 μm)에 여과시킨 후, 내부표준물질 (Internal standard, ISTD) 100ng 및 buffer (pH 7 ± 0.5) 80 μL를 ᅠ주입하였다. 다양한 물리화학적 특성을 가지는 물질들을 분석하기 위해서, 4종류의 흡착 물질 OASIS HLB, Isolute ENV+, Strata X-AW 및 Strata X-CW로 이루어진 다층 SPE 카트리지 (multi-layer cartridge)를 사용하였다. 시료를 5 ~10 mL/min의 유속으로 카트리지에 흘려 보낸 후, 시료 loading이 끝난 카트리지는 케이스 안에 고압 질소가스를 분사하여 1시간동안 건조시켰다. 건조가 완료된 카트리지는 추출을 위해 두 가지 용매인 알칼리 용액 6 mL (ethyl acetate/methanol 50 : 50 with 0.5%ᅠ ammonia) 및 산성 용액 (ethyl acetate/methanol 50 : 50 with 1.7% formic acid)를 통해 추출하였다. 추출 용액은 질소농축기(CHONGMIN TECH, Korea)를 이용하여 35oC에서 0.1 mL까지 농축시킨 후, pure water/methanol (9 : 1)을 주입하여 1 mL로 재구성하였다. 1 mL 시료는 cellulose acetate filter (0.2 μm)을 이용하여 여과한 후, 분석용 vial에 담아 기기분석 전까지 4oC 냉장보관하였다.
2.4. 기기분석
대상물질 148종에 대한 다성분 동시분석 위해 LC-HRMS을 사용하였고, 기기는 Ultimate 3000 ultra high performance chromatography (Thermo Fisher scientific, USA)에 HESI가 결합된 Q Exactive plus quadrupole Orbitrap mass spectrometry (Thermo Fisher scientific, USA)를 결합하여 사용하였다. 물질의 분리에는 Xbridge C18 column (2.1 × 50 mm, particle size 3.5 μm)을 사용하였고, 이동상으로는 pure water with 0.1% formic acid (A)와 methanol with 0.1 % formic acid (B)가 이용되었다. 시료 용액의 injection volume은 10 μl이고, 컬럼 온도 35oC에서 B의 비율을 10%로 시작하여 4분 동안 50%까지 증가시키고, 17분까지 95%로 증가시킨 후 25분까지 유지하였다. 25분 후 column의 평형 상태 유지를 위하여 이동상 B의 비율을 10%로 급격히 감소시켜 2분 동안 유지시켜 주었고, 총 분석시간은 29분 동안 이루어졌다. 이 동상의 유속은 0.2 mL/min으로 유지시켰으며, 모든 시료는 positive 및 negative mode에서 분석되었다. Capillary 온도와 spray voltage는 320oC 및 positive, negative mode에서 각각 3.8 kV, 3.0 kV로 설정하였다. Column oven의 온도는 35oC로 맞춰주었다.
2.5. QA/QC
정량분석은 내부표준법 (internal standard calibration)을 사용하여 수행되었으며, 분석방법의 정확도와 신뢰도 검증을 위해 검량곡선의 직선성과 검출한계 (LOD, limit of detection), 정량한계 (LOQ, limit of quantification), 절대 회수율 (Absolute Recovery) 및 정밀도를 검증하였다. 검출한계와 정량한계 확인은 크로마토그램상에서 나타난 피크의 S/N비율 (signal to noise ratio) 를 확인하여 측정하였다. S/N비율 값이 3이상일 경우 검출한계로 하였으며 정량한계는 10이상으로 설정하였다. 11단계의 농도 범위 (0.1, 0.5, 1, 2, 5, 10, 20, 50, 70, 100, 200 ng/L)의 표준용액에 대하여 100 ng의 internal standard를 주입하여 검량곡선을 작성하였다.
3. 결과 및 고찰
3.1. QA/QC 결과
정량분석을 위한 검정곡선의 직선성을 나타내는 R2 값은 모든 대상물질에 대하여 0.99 이상으로 나타났으며, 분석의 정밀도를 확인하기 위한 상대표준편차값 (Relative standard deviation, RSD)은 25.0% 이내의 준수한 수준으로 확인되었다. 검출한계 (LOD)는 123종의 물질(83.1%)에 대하여 2 ng/L 이하로 정량한계 (LOQ)는 145종의 물질 (97.8%)에 대하여 10 ng/L 이하로 나타나 높은 민감도를 보여주었다 (Table 2). 증류수를 이용한 대상물질에 대한 절대 회수율 (Absolute Recovery)의 경우, 모두 28~285% 이내로 나타났고, 이들 중 118종 (79.7%)에 대 하여 75~125% 이내로 나타나 높은 회수율을 보여주었다.
3.2. 정량분석 결과
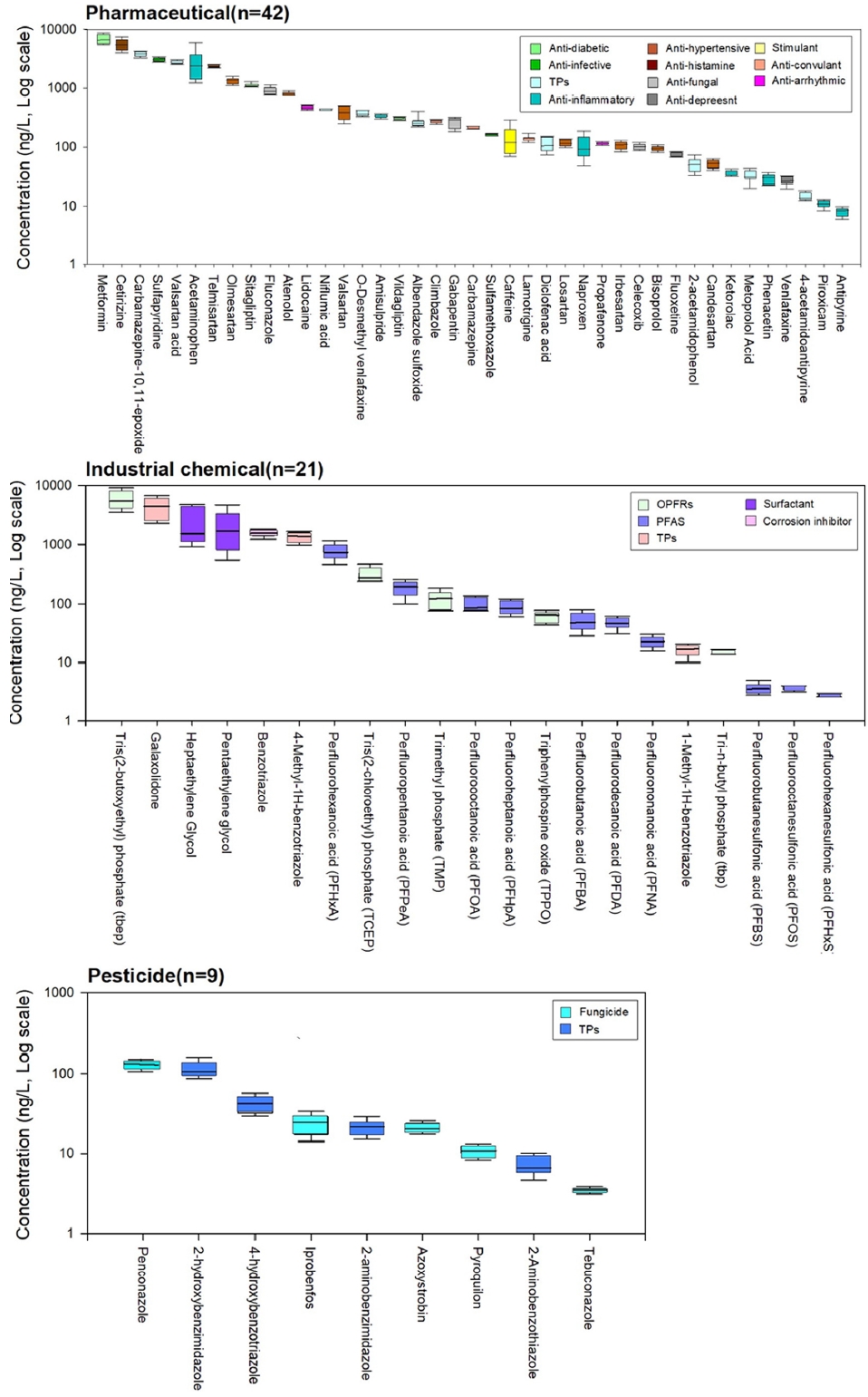
정량분석 결과 대상물질 148종 중 71종이 LOQ 이상의 농도로 검출되었으며, 이들 중 농약은 9종 (12.7%), 의 약품은 41종 (57.7%), 산업용제 및 기타물질은 21종 (29.6%)로 나타났다 (Fig. 2).
주요 오염물질은 유기인계난연제 (Organophosphate flame retardant, OPFRs)로 사용되는 Tris(2-butoxyethyl) phosphate (TBEP)가 최대 14,000 ng/L으로 검출되었으 며, 이 외에도 Metformin, Pentaethylene glycol, Cetirizine, galaxolidone, Acetaminophen, Heptaethylene glycol, Carbamazepine-10,11-epoxide, Sulfapyridine, Valsartan acid, Telmisartan, Fluconazole, Benzotriazole, Olmesartan, 4-Methyl-1H-benzotriazole, Sitagliptin, Perfluorohexanoic acid (PFHxA)가 최대 1,000 ng/L 이상으로 높게 검출되었다. 물질그룹별로 나누어 보면, 의약품 중에서는 당뇨병 치료제 (Metformin, Sitagliptin), 항히스타민제 (Cetirizine), 항염증제 (Acetaminophen), 항경련제 대사체 (Carbama-zepine-10,11-epoxide), 고혈압 치료제 대사체 (Valsartan acid), 항감염제 (Sulfapyridine), 고혈압 치료제 (Telmisartan, Olmesartan), 항진균제 (Fluconazole)가 1,000 ng/L 이상 높은 농도로 나타났다. Acetaminophen (1,190~6,500 ng/L), Caffeine (320~65 ng/L), Naproxen (290~26 ng/L)의 경우, 시료 채취기간 동안 시간에 따른 농도 변화가 크고, 특히 오전 3~6시경 가장 높은 것으로 나타났다. 인근에 위치한 서부하수처리장 및 성서폐수처리장은 24시간 지속 방류가 이뤄지고 있어 방류시간에 의한 영향은 어렵다고 판단된다. 해당 물질의 경우, 일반적으로 인간의 주간 생활시간인 오전 7시~오후 6시에 사용량이 많으며, 하폐수처리장에 유입된 후 수처리 과정 (18~19시간)을 거쳐 지표수로 방류된다. 해당 물질 사용량이 많은 특정 시간대 또한 농도 변화의 원인 중 하나로 판단된다. Valsartan acid는 valsartan, losartan, irbesartan의 주요 대사물질로, 하수처리과정이 주요 생성 원인으로 알려져 있다[17,18]. 검출된 물질 그룹 중 고혈압 치료제는 총 42종의 의약물질 중 8종 (19%)를 차지하고 있으며, 고혈압 치료제로 주로 쓰이는 sartan 계열의 물질들은 꾸준히 지표수에서 높은 농도로 자주 보고되고 있다. 특히, Telmisartan의 경우, 최근 몇 년 간 낙동강 수계에서 높은 농도로 검출되고 있으며[19,20, 선행 연구에서 지표수 내 우선순위물질 선정에서 높은 순위로 선정된 바 있어 수생태계 내 악영향을 미칠 것으로 판단된다. 이 외에도 고혈압 치료제 (Atenolol), 구충제 대사체 (Albendazole sulfoxide), 항부정맥제 (Lidocaine) 당뇨병 치료제 (Valsartan) 등이 주요 물질로써 확인되었다. 다른 물질 그룹 (농약, 산업용제 및 기타) 에 비해 상대적으로 많은 종류의 물질이 검출되었으며, 이는 시료 채취 지점 인근에 위치한 하폐수처리장이 그 원인으로 사료된다.
산업용제 및 기타물질의 경우, 유기인계난연제 (Tris(2-butoxyethyl) phosphate (TBEP), Tris(2-chloroethyl) pho-sphate (TCEP)를 비롯한 합성항료 대사체 (Galaxolidone), 부식방지제 대사체 (4-Methyl-1H-benzotriazole), 계면활성제 (Heptaethylene glycol, Pentaethylene glycol), 부식방지제 (Benzotriazole), 과불화화합물 (Per-and poly-fluoroalkyl substances, PFAS) PFHxA가 높은 농도로 검출되었다. 유기인계 난연제는 생물농축성 및 난분해성 특성으로 인해 사용이 금지된 브롬계난연제 (e.g, PBDES)의 대체제로 사용량이 급격히 증가하면서 지표수에서 높은 농도로 검출되고 있다[21,22,23]. Benzotriazole은 친수성이 강해 하폐수처리장에서의 제거효율이 낮아 지표수 내 비교적 높은 농도로 분포한다[24]. 과불화화합물은 총 10종이 확인되었고 그 중 PFHxA 및 Perfluoropentanoic acid (PFPeA)가 주요 물질로 확인되었다. 이를 제외한 과불화화합물들은 다른 산업용제에 비해 상대적으로 낮은 농도로 나타났지만, 낙동강 수계에서 다양한 형태의 과불화화합물이 존재하고 있는 것으로 판단된다. 농약은 살충제 대사체 (2-hydroxybenzimidazole), 살균제 (penconazole)가 100 ng/L 이상으로 나타났고, 다른 물질 그룹에 비해 상대적으로 낮은 농도로 검출되었다. 시료 채취 일자인 5월의 경우, 한창 농약 사용이 증가하는 시점이지만 검출된 농약의 종류 및 농도가 낮은 것은 시료 채취 지점 위치상 공단 및 하폐수처리장 근처에 있어 농약의 주요 유입 원인인 농경지 및 토양 유출에는 비교적 영향을 덜 받기 때문이라 판단된다. 경작시기에 따라 물질 및 사용량이 달라지겠지만, 인근에 위치한 대규 상류의 농경지역에 영향을 받는 강창교와 비교했을 때, 27종이 검출된 강창교와 달리 단 9종만이 검출되었다. 또한 검출된 농약의 농도합이 1,000 ng/L 이상인 강창교와 비교하여 360 ng/L으로 약 3배정도 차이가 났다16.
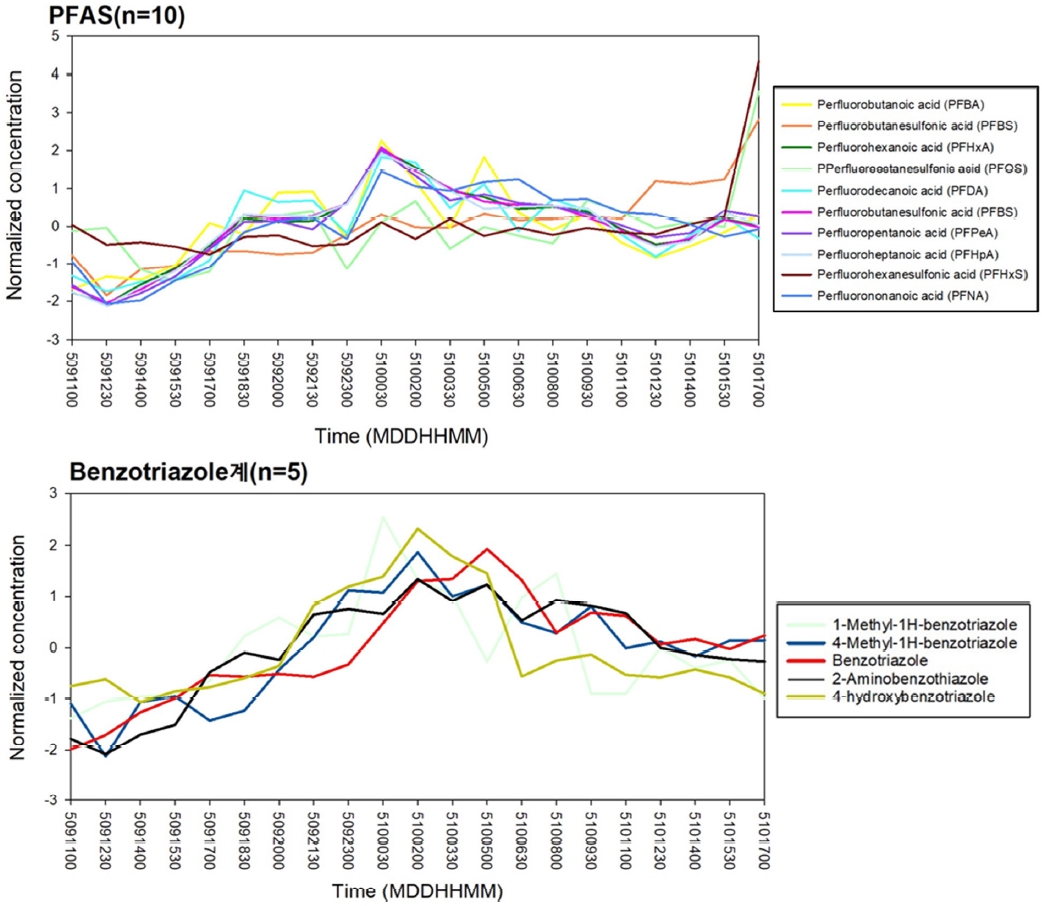
3.3. 농도변화 추이
검출된 71종의 물질들의 시료 채취 기간 동안의 농도는 다양한 형태로 나타났으며, 시간이 경과함에 따라 농도가 일정한 물질, 서서히 농도가 감소 또는 증가하는 물질, 시간과 관계없이 농도가 급격히 변하는 물질 등이 포함되어 있다. 그 중 특이적으로 과불화화합물과 benzotriazole 계열의 물질들이 각각 시간에 따른 비슷한 농도 변화 경향성이 나타났다 (Fig. 3). 과불화화합물은 인위적으로 만들어진 유기화합물 중 한 종류로[25,26], 강력한 C-F 화학결합으로 높은 잔류성을 지녔으며, 열적으로 안정하고, 방수, 방오, 발유 특성으로 인하여 1950년대부터 광범위하게 사용되어 왔다[27,28]. 그러나 PFAS 물질은 쉽게 분해되지 않기 때문에 환경 및 인체 내에서 광범위하게 발견되고 있으며, 발암성, 생농축성, 생식독성을 지닌 잔류성 독성 물질로 알려져 있다. 이런 특성으로 인해 국제적으로 PFAS물질의 사용 및 유통이 규제되고 있다. 검출된 과불화화합물은 증가하다가 감소하는 형태로, 5월 9일 12시 30분을 기점으로 서서히 농도가 증가하다가 5월 10일 00시 30분인 새벽 시간대에 가장 높게 나타난 후 감소한다. 고농도로 검출된 PFHxA의 경우, 370~1,200 ng/L의 농도 범위를 나타났으며, 이틀이라는 시간에서 약 3배 정도의 농도 변화가 나타났고, 유의미하다고 판단된다. PFHxA의 고농도 검출은 C8~C14 사슬인 PFOA, PFCAS 의 사용이 제한됨에 따라, C6인 비교적 짧은 사슬인 PFHxA을 사용하기 시작함으로써 나타난 현상이라 예상된다. 국내의 경우, PFAS에 대한 전수조사와 사용금지, 규제 마련 촉구 등의 움직임은 계속 있어왔지만, 현재 방류수에 대한 배출 기준 및 관리기준이 없기에 기준이 필요한 상황이다. Benzortriazole은 일반적으로 산업 공정에서 부식방지제 및 세정제로 사용되며, 환경 중 유입 시 다양한 형태의 변환체를 생성한다. 해당 계열의 물질 들 또한 비슷한 양상의 농도 변화를 나타냈는데, 서서히 증가하다가 새벽시간대인 5/10 02시를 기점으로 가장 높은 농도로 검출된 후 서서히 감소하는 것을 볼 수 있다. 이는 앞서 말한 과불화화합물의 시간에 따른 농도변화 그래프와 비슷한 양상을 보이고 있으며, 시료채취 지점 인근에 위치한 대규모 공단에서 발생되는 폐수의 영향으로 판단된다. 과불화화합물 및 benzotriazole은 산업공정에서 주로 사용되는 물질로써 인근 공단에서의 주 사용시간 또한 요인 중 하나라 보여진다. 추후 장기간 시료채취를 통한 두 물질에 시간에 따른 농도변화의 상관관계를 파악할 필요가 있다.
4. 결 론
본 연구에서는 지표수 내 존재하는 미량오염물질의 분포 및 일부 물질 그룹의 시간에 따른 농도 변화를 파악하기 위해 148종의 물질에 대한 LC-HRMS 기반 정량분석을 수행하였다. 그 결과 총 71종의 물질이 LOQ 이상의 농도로 검출되었고, 하폐수처리장 인근에 위치한 시료 채취지점 특성 상 다른 물질 그룹에 비해 의약품이 가장 많은 물질을 포함하였다. 주요 오염물질로는 유기인계난연제로 사용되는 TBEP가 최대 14,000 ng/L으로 검출되었으며, 이 외에도 Metformin, Pentaethylene glycol, Cetirizine, galaxolidone, Acetaminophen, Heptaethylene glycol, Carbamazepine-10,11-epoxide, Sulfapyridine, Valsartan acid, Telmisartan, Fluconazole, Benzotriazole, Olmesartan, 4-Methyl-1H-benzotriazole, Sitagliptin, PFHxA가 최대 1,000 ng/L 이상으로 높게 검출되었다. 검출된 물질들이 시간 경과에 따른 농도 변화는 다양한 양상으로 나타났으며, 특히 대상물질 중 과불화화합물과 benzotriazole 계열의 물질들이 각각 시간에 따른 비슷한 농도 변화를 나타냈다. 또한 두 물질 그룹 모두 새벽시간대인 5/10 00시 30분~02시에서 가장 높은 농도를 나타냈으며, 그 후 서서히 감소하는 양상을 보여줬다. 이러한 농도 변화의 주 요인으로는 시료채취지점 인근에 위치한 하폐수처리장의 방류수로 보여지며, 인근의 대규모 공단에서 해당 물질을 사용하는 시간대 또한 요인 중 하나로 보여진다. 약 이틀 간의 짧은 채취기간임에도 불구하고, 일부 물질의 경우 농도 변화 폭이 컸으며, 시간에 따른 수생태계에 미치는 위해성 또한 변화할 것이라 사료된다. 추후, 채취 기간을 늘려 지표수 내 미량오염물질 농도의 경향성을 파악하고, 농도 변화로 인한 수생태계 내 위해성 변화를 확인할 필요가 있다.
Acknowledgements
이 연구는 2022년도 창원대학교 대학원 전일제 연구 장학생 지원사업으로 수행되었습니다.