|
 |
- Search
| J Environ Anal Health Toxicol > Volume 23(4); 2020 > Article |
|
ABSTRACT
The research scope of microplastics in aqueous environment has been expanding from investigation of their presence in oceanic water to the analysis of their distribution and behavior in freshwater. However, research in aqueous environment is limited because the lack of standardized evaluation techniques has resulted in the use of various unrelated analysis methods, thus making it difficult to compare data on microplastic contamination and distribution. Given their known oceanic distribution, a survey on the occurrence of microplastic contamination and behavior in the freshwater environment needs to be conducted using a precise and accurate standard analytical method. Such a method would facilitate a systematic and uniform approach to domestic and international safety management and to the development of improvement plans needed to mitigate microplastic contamination. In this study, we have summarized the technologies recently applied for microplastic analysis and for the investigation of microplastic occurrence in the freshwater environment. We have also presented a review on the analysis and evaluation of microplastic contamination in the future.
세계 플라스틱 생산량은 지난 10년간 42% 증가해 3억 5천만 톤을 기록했고(2017년), 2030년에 5억 5천만 톤의 플라스틱 생산량이 예측된다. 세계 플라스틱 누적 생산량은 2017년까지 83억 톤이며, 약 75%가 폐플라스틱으로 배출되고, 이 중 9%만 재활용되고, 매립 또는 환경 내 축적 (79%) 및 소각 (12%)으로 처리된다. 또한 2050년 120억 톤의 폐플라스틱이 매립 또는 환경 내 축적될 것으로 예측된다[1]. 우리나라의 경우 2015년 기준 약 10.1백만 톤이 발생하였고 연간 플라스틱 소비량은 876만톤으로 세계 1위(한국 98.2kg, 미국 97.7 kg, 프랑스 73 kg, 일본 66.9 kg)이며, 플라스틱 폐기물 발생의 증가추세는 더욱 확대될 전망이다[2]. 현재 사용되고 있는 플라스틱은 폴리에틸렌 (Polyethylene, PE), 폴리프로필렌 (Polypropylene, PP), 폴리비닐클로라이드 (Polyvinyl Chloride, PVC), 폴리스티렌 (Polystyrene, PS) 및 폴리에틸렌테레프탈레이트 (Polyethylene Terephthalate, PET)가 전체 생산량의 90% 차지한다. 세계 1차 플라스틱 생산량 중 75%가 폐기되며, 사용분야 중에서는 포장재가 가장 큰 비중을 차지하며 사용기간이 6개월 이하로 가장 짧다 (건축자재 플라스틱은 사용기간이 35년임) [1].
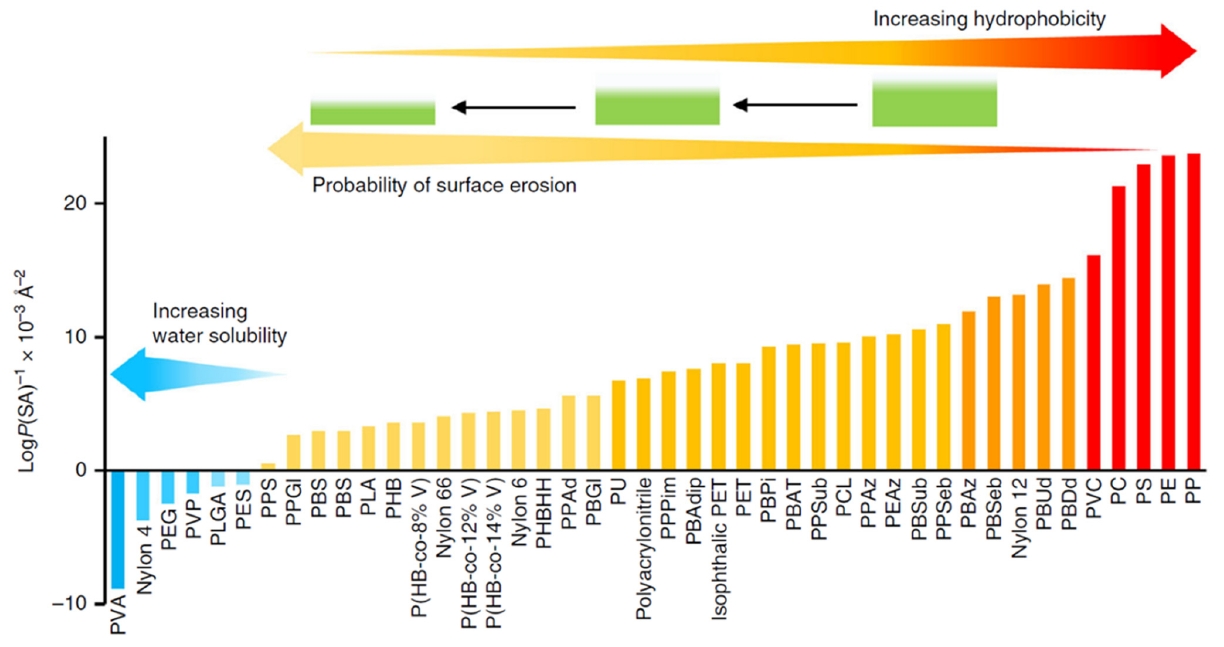
미세플라스틱은 일반적으로 길이가 5 mm 이하의 고체 불용성 고체(Any solid plastic particle insoluble in water)로 정의하고 있으나, 그 이하의 크기에 대해서는 다양하게 해석되고 있다. UNEP은 수용성 분해가 불가능한 5 mm 이하의 고체 플라스틱 입자로 정의[3]하고, 국제표준화 ISO/TC 61(Plastics)/SC 14 (Environmental Aspect)은 ISO/TR 21960:2020 표준안 terms and definitions 에서 1 µm에서 1000 µm 크기의 물에 용해되지 않는 고형의 플라스틱 입자(any solid plastic particle insoluble in water with any dimension between 1 µm and 1000 µm)라고 규정한다[4]. 또한 화장품, 청소용품, 공업용 연마제 등에 사용하기 위해 생산된 1차 미세플라스틱과, 플라스틱이 사용, 소모, 폐기되는 과정 중 인위적으로 또는 자연적(환경 중 열, UV, 미생물 등에 의해서 분해)으로 미세화된 2차 플라스틱으로 구분된다[5]. 미세플라스틱의 풍화 및 마모(weathering)는 환경 요인(생물적 및 비생물적) 뿐만 아니라 플라스틱 종류에 따른 분자 구조, 유리전이 온도, 소수성 등 물리화학적 특성에 따라 분해속도가 달라진다[6]. (Fig. 1)
미관리 플라스틱 폐기물은 년간 32백만 톤이 환경으로 유입되며, 년간 5-13백만 톤이 해양으로 유입된다[1] (Fig. 2). 하수처리장으로 유입된 미세플라스틱은 3차 처리(tertiary treatment, 고도처리)를 통해 대부분 제거되고 0.1%가 배출되지만, 유럽에서만 하폐수 방류수를 통해 52 만톤/년의 폐플라스틱이 배출되는 것으로 추산되며, 하수슬러지로 제거된 미세플라스틱은 퇴비 등의 형태로 다시 담수로 유입되는 중요한 점오염원이다[7]. 플라스틱 제조시설 및 사용·폐기된 플라스틱, 하수처리장 배출수 등에서 기인한 플라스틱의 70-80%가 하천을 통해 해양으로 유입되고 있지만, 관련 조사가 제한적이어서 환경 내 미세플라스틱 유입 및 거동에 대한 연구가 필요하다.
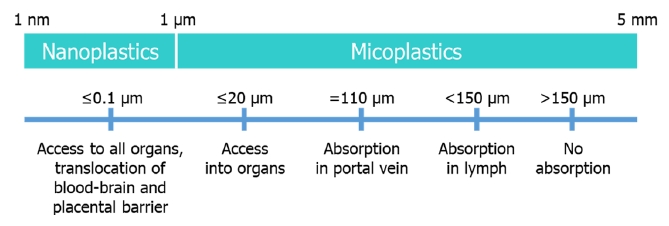
미세플라스틱 섭취를 통해 인체에 축적되는 정도, 위해성 기전 등 인체 건강영향 규명을 위한 인체 노출에 따른 위해성평가 연구가 미진한 실정이다. 다만 미세플라스틱 입자 크기 및 형태, 화학적 성질 등에 따라 물리적 및 화학적으로 체내에 흡수되어 체내 조직과 기관에 영향을 미칠 가능성이 있다. 150 µm 이상의 미세 플라스틱은 포유류 내 흡수가 불가하며 (Fig. 3), 경구로 섭취된 경우 약 90% 이상이 배변활동을 통해 배출되는 것으로 보고됐다[8]. 입자 크기가 150 µm 보다 작은 미세플라스틱은 소화관 내벽을 통과할 수 있어 전신적 노출이 발생할 가능성 있다 (단, 흡수율은 0.3% 이하). 특히 입자 크기가 0.2 µm 이하인 경우 체내 다른 조직 및 기관으로 흡수되어 국부적 면역체계 이상 및 장염증을 일으킬 수 있으며, 0.1 µm 이하의 나노플라스틱은 모든 기관에 흡수 가능하며, 혈액뇌장벽 및 태반장벽을 통과하여 면역저하, 과민 면역반응, 비정상적 염증 반응 등의 부작용을 일으킬 수 있다[8,9].
미세플라스틱은 그 자체로도 인체 위해성을 나타날 가능성이 높을 뿐만 아니라, 플라스틱 제조과정 중에 사용된 중합체와 첨가제는 미세플라스틱이 마모되면서 용출될 가능성이 있다. 플라스틱의 제조 시에는 성형의 용이성과 기능성 향상을 위해 다양한 화학물질(프탈레이트 가소제, 중금속 첨가제, 열안정제, 난연제 등)이 평균 4% 비율로 첨가되는데 이러한 첨가제도 미세플라스틱을 통해 인체 내로 이동하여 내분비계를 교란시킬 수 있다[8]. 또한 소수성이 강한 잔류성 유기오염물질(Persistent organic pollutants, POPs)을 흡착하여 독성물질 매개체가 될 수 있다. 플라스틱이 풍화되어 잘게 부서지면 부피당 표면적이 커지며 화학물질을 용출 및 흡착할 가능성이 높아지며, 생물의 체내에 유입될 경우 외부에서 흡착된 유·무기 오염물질이 탈착되거나 플라스틱 첨가제가 침출되어 안전성 문제가 발생할 수 있다. 플라스틱의 소수성 표면에 잔류성 유기오염물질(POPs) 및 잔류성 생물축적 독성물질 (persistent, bioaccumulative, toxic, PBTs)가 쉽게 흡착하고 농축(105~106배)되어 매개체 역할을 할 수 있다(Fig. 4) [11,12].
플라스틱 폐기물 및 미세플라스틱 등으로 인한 환경 및 건강영향에 대한 우려가 확산됨에 따라 플라스틱 폐기물에 대한 글로벌 규제가 강화될 전망이다. 영국은 2042년까지 불필요한 플라스틱 폐기물 제로화를 발표(’18.1)했고, EU에서는 일회용품 등 금지 저감 규정이 의회를 통과(’18.12)했다. 또한 미세플라스틱이 포함된 제품(화장품 및 개인 케어용품, 페인트·코팅·잉크, 세정제, 연마제, 오일 및 가스, 농업, 의약품 등) 등 1차 미세플라스틱의 사용·생산·유통에 대한 국가별 관리 및 규제가 시행되고 있다 (Table 1).
우리나라의 경우, 「화장품 안전기준 등에 관한 규정(’17.1)」에 화장품 원료로 미세플라스틱(세정, 각질제거 등의 제품에 남아있는 5 mm 이하 고체플라스틱) 사용 금지항목 추가한 후, 제조·수입금지(’17.7) 및 판매 금지(’18.7)를 시행하였다. 또한 「의약외품 품목허가 신고·심사규정」에 미세플라스틱을 사용한 의약외품의 제조 또는 수입이 금지(’17.7)되었으며, ‘18년 7월 해당 의약외품 판매 금지(5mm 미만 고체플라스틱 사용 구중 청량제, 치약제, 구강위생 등에 사용하는 제제)(’18.7)되었다[13].
이와 같이 플라스틱 폐기물 및 미세플라스틱 등으로 인한 환경 생태계 및 인체 건강영향에 대한 우려가 전세계적으로 확산됨에 따라, 정밀도 및 정확도 등이 확보되고 표준화된 미세플라스틱 분석방법을 토대로 환경 중 미세플라스틱 오염도 및 거동 실태조사가 선행되어야 한다. 이를 통한 미세플라스틱 오염도 저감을 위한 국내외 체계적인 관리 및 개선방안 수립 및 시행이 필요하다. 따라서, 본 논문에서는 미세플라스틱 분석방법 및 담수 물환경에서의 미세플라스틱 검출현황 등을 조사하여 향후 미세플라스틱 오염도 분석 및 평가에 관한 고찰을 제시하고자 한다.
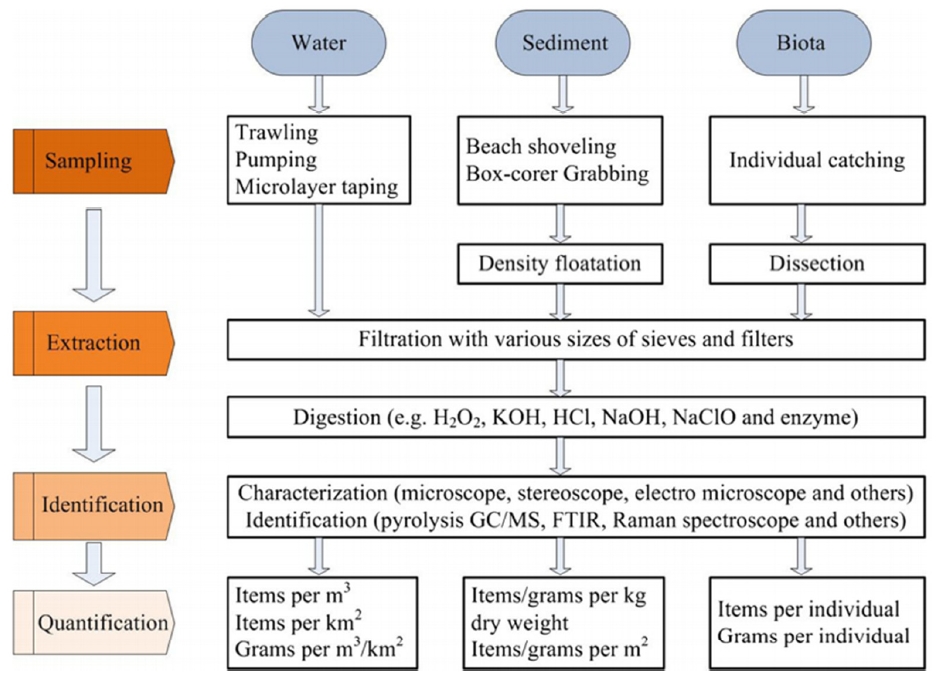
수질시료를 포함한 환경매체별 미세플라스틱 분석은 시료 채수(sampling), 추출 및 분리(isolation, separation), 정성(identification), 정량(quantification), 범주화(classification)로 구분된다(Fig. 5) [15,16].
수질시료의 경우 샘플링 방법 및 채수량(면적 또는 부피), 분석방법에 따라 미세플라스틱 검출결과의 단위가 결정된다 (개/m3 또는 km2, µg/m3 또는 km2). 수질시료 중 미세플라스틱은 그물망을 이용하여 채수(volume-reduced sampling)하거나 정해진 용량만큼 채수(bulk sampling)하여 분석한다. 그물망을 이용한 채수방법은 manta trawl, neuston net, plankton net 등이 설치된 배를 이용하여 시료를 채취한 면적이나 그물을 통과한 유량을 측정하고, 이후 채취된 미세플라스틱을 분석한다. 넓은 지역의 시료를 채취할 수 있는 장점이 있지만, 주로 수표면에 있는 미세플라스틱을 대상으로 하여 밀도가 큰 미세플라스틱(PVC, PET 등) 채취가 제한된다. 또한 그물망의 크기에 따라 채취할 수 있는 미세플라스틱의 크기가 제한된다는 단점이 있다. Manta trawl은 일반적으로 330 µm mesh 그물망을 사용하여, 이 이하의 미세플라스틱 채취가 불가능하다. 미세플라스틱 크기가 더 작을수록 개수 및 중량, 위해성이 증가하는 특징을 고려하면, 원래 존재하는 농도 및 위해성보다 과소평가될 우려가 있다[17]. 반면에 정해진 용량만큼 채수하면 다양한 크기범위의 미세플라스틱을 채취할 수 있으나, 채수 지점(수심)에 따른 채취 가능한 미세플라스틱 종류의 제한과 좁은 시료채취 면적 및 채수량에 따른 시료의 대표성(균질성) 확보 문제가 발생한다. 미세플라스틱 시료 채수량이 너무 적으면 입자 채취의 오차범위가 커지고, 채수량이 너무 많으면 현실적 어려움 뿐만 아니라 미세플라스틱을 제외한 유·무기 물질 제거를 위한 시료 전처리의 부하량 증가로 분석의 어려움이 생긴다. 또한, 수질시료의 대표성을 갖는 시료 채수량은 수질매체별 미세플라스틱을 포함하는 입자상물질 농도에 따라 달라지며, 독일연방재료연구소(BAM)에서 권고하는 미세플라스틱 입자크기별 시료채수량을 Table 2에 나타내었다[18]. 따라서 향후 물환경 중 존재하는 다양한 미세플라스틱 종류 및 크기의 범위를 반영하고 수질시료의 대표성 및 균질성을 확보하기 위해 현실적으로 적용 가능한 표준화된 시료 채취 방법에 대한 연구가 요구되어진다.
다양한 물질이 존재하는 수질시료 중 미세플라스틱을 분리 및 추출하는 전처리는 크게 무기입자 분리 및 유기물질 제거로 구분된다. 채취된 시료에는 미세플라스틱 입자 이외에 모래, 점토 등과 같은 입자성의 물질이 존재하여 밀도 차이를 이용하여 분리한다. 일반적으로 밀도가 1.2 g/cm3인 NaCl 용액이 가장 많이 이용되며, 비중이 큰 플라스틱을 분리할 때에는 NaI(1.6 g/cm3), ZnBr2(1.7 g/cm3)등이 이용된다 (Table 3). 이 용액에 채취한 시료를 혼합한 후 일정 시간 정치시키면 밀도가 큰 무기입자들은 용액 하부로 침전하고 밀도보다 가벼운 플라스틱은 용액 상부에 부유하므로 이를 채취하여 분석에 이용한다. 미세플라스틱 밀도분리시 반드시 재현성이 높은 회수율을 고려해야 하고, 각 매체별로 분리효율과 비용, 독성 등을 고려한 표준화된 방법의 개발이 필요하다[17].
미세플라스틱을 무기입자와 분리한 후에는 플라스틱 표면의 오염물질을 제거해야 기기분석시 방해작용을 최소화할 수 있다. 플라스틱 표면의 유·무기 오염물질 제거를 위해 30% 과산화수소(H2O2), 펜톤산화(H2O2+Fe II salt), 산 분해(H2SO4, HNO3, HClO4 등), 염기 분해(KOH, NaOH 등), 효소 분해(proteinase, lipase, cellulase 등)과 같은 방법이 단독 또는 혼합 사용되고 있다. 농도, 반응시간, 온도 등이 조건을 상승시키면, 유기물 분해 및 제거효율이 증가하지만 미세플라스틱의 분해가 발생할 우려가 있어 플라스틱의 손상을 최소화할 수 있는 전처리 방법의 표준화가 필요하다[20].
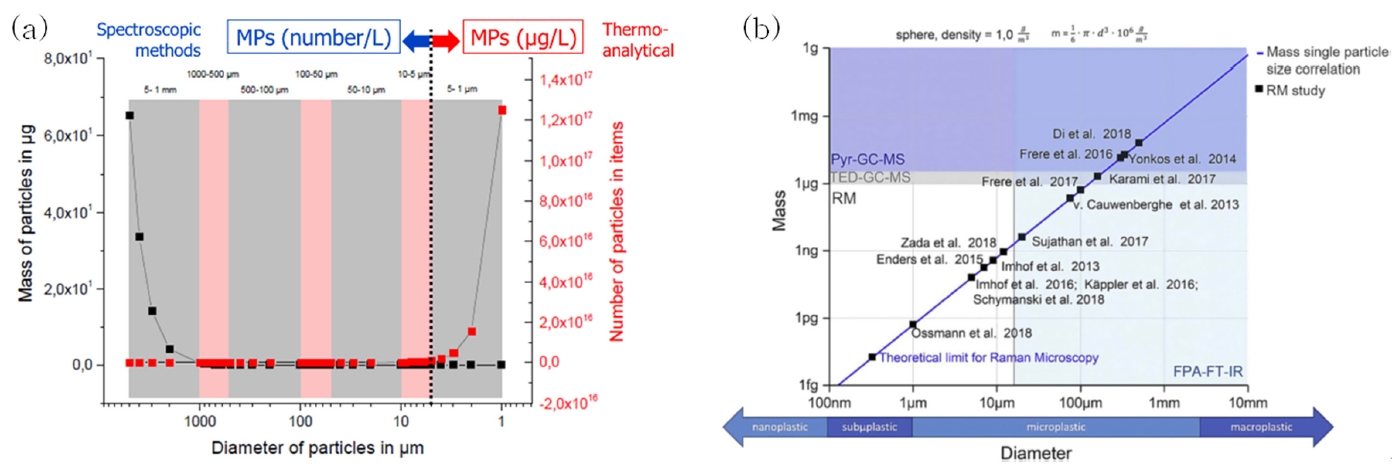
미세플라스틱 분석방법은 분광(spectroscopic) 및 열분석(thermoanalytical) 기반으로 크게 구분된다. 미세플라스틱은 약 5 µm 기준으로 크기가 작을수록 개수가 기하급수적으로 증가하고, 크기가 커질수록 질량이 지배하는 경향을 보인다 (Fig. 6a). 따라서 미세플라스틱 분석대상 크기에 따라 5 µm 이상은 개수 기준(개/시료 부피), 그 이하는 질량 기준(질량/시료부피)으로 측정하는 분석방법 및 분석기기 선택이 필요하다 (Fig. 6b). 분광분석법은 질량보다는 분석대상 미세플라스틱 입자 크기에 따라 기기가 달라지며(상이한 광원 입사광의 파장으로 인해 FT-IR: 20 µm 이상, Raman: 1 µm 이상), 형태 및 크기 측정이 가능한 정량법이지만 전처리 단계 필요 등으로 다소 긴 분석시간을 요한다. 반면에, 열분해 분석법은 미세플라스틱 크기범위를 제한하지는 않지만, 분석기기 검출한계 이상의 시료량이 요구되며 기기상의 피크 및 질량 분리과정을 통해 전처리 단계 축소 및 분석시간 절약 등의 장점이 있다 (Fig. 6b, Fig. 7).
미세플라스틱 측정을 위한 비파괴 분광분석법은 광학현미경(optical microscope)이 결합된 퓨리에 변환 마이크로-적외선분광법(Microscope Fourier transform infrared, µFT-IR)과 마이크로 라만(µRaman) 분광법이 최근에 가장 많이 이용되고 있다. 분자를 구성하는 화학적 원자들은 항상 운동을 하고 있고 이 운동을 진동(vibration) 이라고 하며, 이 분자 운동은 bending, stretching (symmetrical, asymmetrical)으로 구분된다 (vibration rate은 단위 초당 수백만 회). 따라서 각 분자들의 진동은 고유의 진동수(주파수)를 가지며, 이는 원자들 사이의 화학결합의 길이와 각 원자의 질량에 의해 결정된다. FT-IR에서 dipole moment를 가진 분자들이 진동을 함에 따라서 이 분자진동의 주파수가 IR beam 주파수와 일치하게 되면 그 주파수가 흡수되게 된다. 적외선 광원에서 방출된 IR beam의 일부가 시료에 의해서 흡수가 되고 나머지는 detector에 도달하여 측정이 된다. 따라서 나머지 IR beam은 광원에서 방출된 IR beam과 비교하여 주파수(frequency, wavelength, wavenumber)의 함수로 시료의 IR스펙트럼이 작성되며, 흡수도 띠의 위치와 강도로 미세플라스틱의 화학적 결합 등의 정성 분석이 가능하다[24].
Raman 효과란 레이저 광원의 단일 파장의 빛을 시료에 조사했을 때 시료와 레이저 광원의 상호작용으로 인해서 입사광과 동일 파장을 가진 빛(elastic scattering) 이외에 그보다 긴 파장이나 짧은 파장의 빛(Raman scattering)이 산란되어 나타나는 현상을 말한다. 이러한 Raman 효과는 FT-IR과 마찬가지로 분자의 진동에너지 준위 사이에서 기인되며, 플라스틱 종류별 Raman shift에 따른 fingerprint 및 C-H stretch 구간의 스펙트럼으로 정성 분석이 가능하다 (Fig. 8). 적외선 분광법에 활성인 작용기와 Raman 분광법에 활성인 작용기는 차이가 있는데 이를 이용하여 두 분석법을 상호 보완적으로 이용할 수 있다. 시료에 미세플라스틱 외의 유기물질이 있을 경우, 분광분석의 방해인자로 작용하므로 전처리 과정에서 이를 제거해야 한다[25].
또한 광학현미경이 결합된 µFT-IR 및 µRaman은 분석하고자 하는 시료의 위치를 확인한 다음, 동일 위치에서 스펙트럼을 측정함으로써 국소 부위의 정보를 얻을 수 있다. 하나의 국소부위를 측정하는 방법을 단일 분석(single point analysis)이라고 하며, 정밀하게 제어되는 자동 스테이지를 x, y축의 일정간격으로 순차적으로 움직여 이미지를 구성하는 방법을 매핑(mapping)이라고 한다 (Fig. 9). 따라서 미세플라스틱 표면의 화학적 매핑이 가능하여 입자의 조성 (고분자의 주된 원자 조성)과 모포러지(morphology) 분석, 분석필터에서의 분포를 통해 미세플라스틱의 정성 및 정량분석이 가능하다.
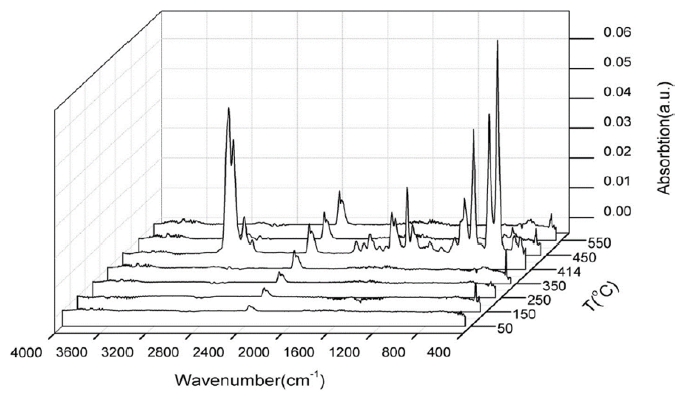
미세플라스틱 종류별 계수를 하는 분광분석법에 비해, 5 µm 이하의 작은 미세플라스틱은 계수의 한계로 질량 기반의 열분석법이 유리하다. 열분석법은 물질의 열적 안정성에 따라 고분자의 물리적·화학적 성질의 변화를 측정하여 미세플라스틱을 구별하는데 유용하다. 가열로(furnace)에서 시료에 온도프로그램을 적용하여 시간이나 온도의 함수로써 시차주사 열량계(differential scanning calorimeter, DSC)는 열유속 차이(difference in heat flow) 및 에너지 양을 측정하고, 열중량 분석기(thermogravimetric analysis, TGA)는 질량변화(changes in mass)를 측정하여 미세플라스틱 시료의 특성을 조사할 수 있다[26]. 하지만 단일 열분석 기기의 사용은 다양한 물질을 포함한 미세플라스틱 시료의 화학조성 및 정량 정보를 제공하는데 한계가 있어서, 최근에는 열분석 및 열분해(TGA, DSC, Pyrolyzer 등) 장비에 IR분광기나 질량분석기(MS)를 결합하여 TGA-IR [27] (Fig. 10), Py-GC/MS [28], TGA-GC/MS [26] (Fig. 11)등의 장비를 활용하면 열분해 거동 중 발생하는 화학조성의 분석이 가능하다.
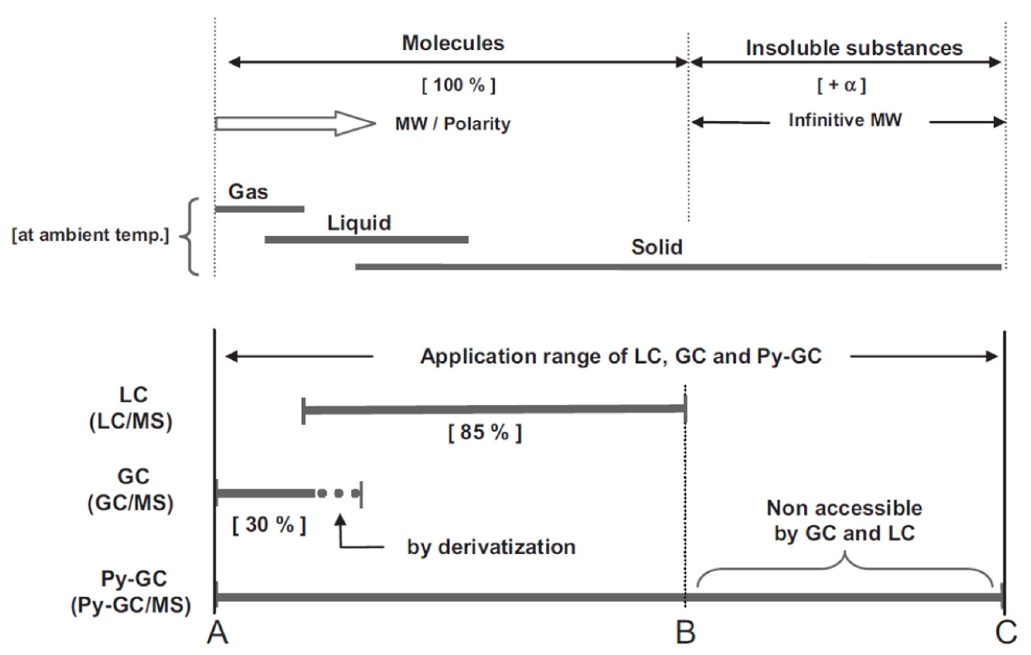
또한 시료 내 미세플라스틱 질량 기준 측정시 GC/MS 및 LC/MS 등 단일 질량분석법 적용이 불가능하며, 고온에서 열분해(thermal degradation 또는 pyrolysis)가 필요한 이유는 다음과 같다. Fig. 12은 분자량(molecular weight(MW)) 및 극성(polarity) 차이에 따른 GC(GC/MS), LC(LC/MS), Py-GC(Py-GC/MS)의 적용 범위를 나타낸다. 대부분의 물질은 분자량에 따라 실온에서 기체, 액체, 고체상태로 존재하며, A~B 범위의 분자들은 해당 용매에서 휘발성(volatility) 및 용해성(solubility)에 따라 GC 및 LC로 적용하여 분석한다. GC로 분석가능한 화합물의 휘발성의 범위는 약 10-7mmHg(10-9 Pa)까지도 확대될 수 있으며 약 30%의 물질이 유도체화를 통해 휘발성 및 열적 안정성을 변화시켜 GC로 분석 가능하고, 적합한 용매 적용을 통하면 85%는 LC로 분석 가능하다. 그러나 B이상 범위의 비용해성 및 비휘발성인 미세플라스틱과 같은 고분자물질은 크로마토그래피로 분리가 불가능하다. 하지만 열 에너지 및 화학적 열분해 등을 통해 생성된 휘발성인 열분해 산물을 분석하는 열분해가 결합된 GC/MS로 고분자 분석이 가능하다[30].
열분해를 이용한 가스크로마토그래피/질량분석법(PyGC/MS)은 무산소 조건 하의 고온에서 미세플라스틱의 열분해를 진행하여 열분해 생성물이 바로 GC/MS로 이동하여 분리되고 검출된다. 열 추출·탈착 가스크로마토 그래피/질량분석법(thermal extraction desorption(TED)-GC/MS)은 열중량 분석기(TGA)에서 시료를 일정한 승온율로 가열함에 따라 시료의 질량변화를 시간이나 온도의 함수로써 측정하고, 이탈하는 온도별 휘발성분을 흡착관에 농축시킨 후, 흡착된 미세플라스틱 분해 산물은 열 탈착기(TD)를 통해 GC/MS로 도입되어 정성 및 정량 분석된다[31,32]. TED-GC/MS는 TGA에서 생성된 열분해 산물의 TD에서의 농축과정을 통해 Py-GC/MS 보다 고감도 분석 가능성이 제시되었다. Py-GC/MS 및 TED-GC/MS는 파괴적 분석방법이지만 다양한 종류의 미세플라스틱에 대한 정성 및 정량 분석이 동시에 이루어지며 비표적 유기 매트릭스 효과는 분광분석법 보다 낮출 수 있다는 장점이 있다.
국내외 담수 및 먹는물 등 수질 매체별(하천수, 호소수, 하폐수 유입수·유출수, 수돗물, 병입수) 미세플라스틱 측정방법(샘플링, 전처리, 분석방법) 및 최근 검출현황을 조사하였다(Table 4). 최근까지 미세플라스틱 연구는 대부분 해양에 집중되어 있고, 상대적으로 담수 및 먹는물 등에서의 연구가 미진하다. 현재 환경매체 중 미세플라스틱 관련 국제 표준분석법 제정은 국제표준화기구(International Standardization Organization, ISO)를 기준으로 ISO/TC61(Plastics)/SC14(Environmental aspects)/WG4(Microplastics)에서 작업 중에 있으며, 특히 수질관련 미세플라스틱 표준분석법은 ISO/TC147 (Water quality)/SC2(Physical, chemical and biochemical methods)에서 제정 중에 있다. 하지만 제정 전까지 국내외 표준분석법 부재로 인하여 샘플링 방법, 전처리 방법, 분석 방법이 모두 상이하였고, 이에 따라 미세플라스틱 조사대상의 크기 및 종류가 달라서 신뢰성 있는 데이터를 토대로 한 상대적인 비교평가가 불가능한 실정이다.
미세플라스틱 조사대상의 크기는 시료채수 방법에 따라 cut-off size가 결정되며 그 이하의 미세플라스틱 채취 및 분석이 불가능하다. 해양분야 등 면적 기준으로 채수를 할때 일반적으로 manta trawl(330 µm mesh)을 이용한 채수방법이 주로 쓰여서 상대적으로 개수가 적은 미세플라스틱 큰 입자에 대한 연구결과가 많아서 정확한 위해성 평가가 어렵다. 전처리 방법은 수질시료 내 유기물질 분해를 위해 과산화수소를 이용한 wet peroxide oxidation(WPO)가 주로 사용되며, 미세플라스틱 분리 채취를 위해 여과가 같이 사용되기도 한다. 기기분석방법은 시료 내 전체 미세플라스틱을 분광분석법(FT-IR, Raman 등) 및 열분석법(Py-GC/MS 등)으로 정성 및 정량하는 방법과 시료 일부분을 광학현미경 등으로 측정하여 계수한 후 일부를 정성분석하여 전체량을 계산하는 방법이 사용되고 있다. 후자는 분석시간 단축 및 분석의 용이성의 장점이 있지만, 시료의 대표성 및 재현성이 보장되지 않는다면 신뢰성 있는 결과를 도출하기 어렵다.
따라서 물환경 및 수질매체별 특성을 고려하여 미세플라스틱 측정을 위한 시료채취(채수량 및 방법), 전처리, 기기분석, 데이터 처리방법의 표준화가 필요하다. 향후 신뢰성있는 표준화된 분석방법을 기반으로 한 국내외 충분한 미세플라스틱 검출 DB가 확보되어야 정확한 오염도 및 분포 평가가 가능하고, 이를 기반으로 미세플라스틱 위해성에 대한 개선 및 관리방안에 대한 연구가 필요할 것으로 보인다.
전세계 플라스틱 생산 및 소비량 증가와 미관리된 폐플라스틱으로 인한 환경 중 미세플라스틱 오염 증가와 인간 및 환경 생태계의 위해성으로 미세플라스틱이 새로운 환경 위해요소로 대두되고 있다. 본문에서 언급했듯이 미세플라스틱 관련 국내외 표준분석법의 부재로 연구사례마다 상이한 분석방법을 이용하였기 때문에 전세계 미세플라스틱 분포를 직접 비교하기 어렵다. 따라서 향후 환경 중 미세플라스틱 오염도 분포 및 인간과 생태계에 대한 위해성 평가를 통한 개선방안 도출을 위해서 시료채취, 전처리, 분석, 데이터처리 방법에 대한 표준화가 반드시 필요하다. 신뢰성있는 표준화된 데이터를 기반으로 플라스틱과 미세플라스틱 관리기반 구축 및 제도 개선을 추진해야 할 것이다.
「환경정책기본법」제14조에 의거한 환경분야 범정부 최상위 계획인「국가환경종합계획(제5차, 2020~2040)」에 따라 미세플라스틱 안전관리체계 구축을 위해 환경 중 이동 모니터링 및 인체 위해성 평가, 미세플라스틱 전 생애(제조, 사용, 배출, 폐기) 단계별 현황조사, 생활화학제품 내 미세플라스틱 규제 등 체계적인 관리 및 제도 개선이 필요하다. 특히 먹는물을 통한 미세플라스틱 노출에 따른 국민 안전성 제고를 위해 물안전관리 기법(Water Safety Plan)을 적용하고 수돗물의 생산-공급 전과정에 대한 모니터링 체계 구축을 위한 계획이 시행될 예정이다. 따라서 미세플라스틱 안전관리체계 구축 및 시행을 위해 향후 미세플라스틱의 분석기술, 거동평가 및 예측기술, 인체 및 생태계 위해성 평가기술 등에 대한 다양한 분야의 연구가 필요하다.
Fig. 7.
Classification of the techniques applied to microplastic identification and quantification, based on their precision/degree of detail (resolution, material identification, quantification) and time [23].

Fig. 8.
Raman spectra for relevant polymers, showing the regions used for type fingerprinting, and for examining their alkyl, alkene, and aromatic proton C-H stretching modes [22].

Fig. 11.
Analysis of polyethylene microplastics in environmental samples through thermal decomposition [29].
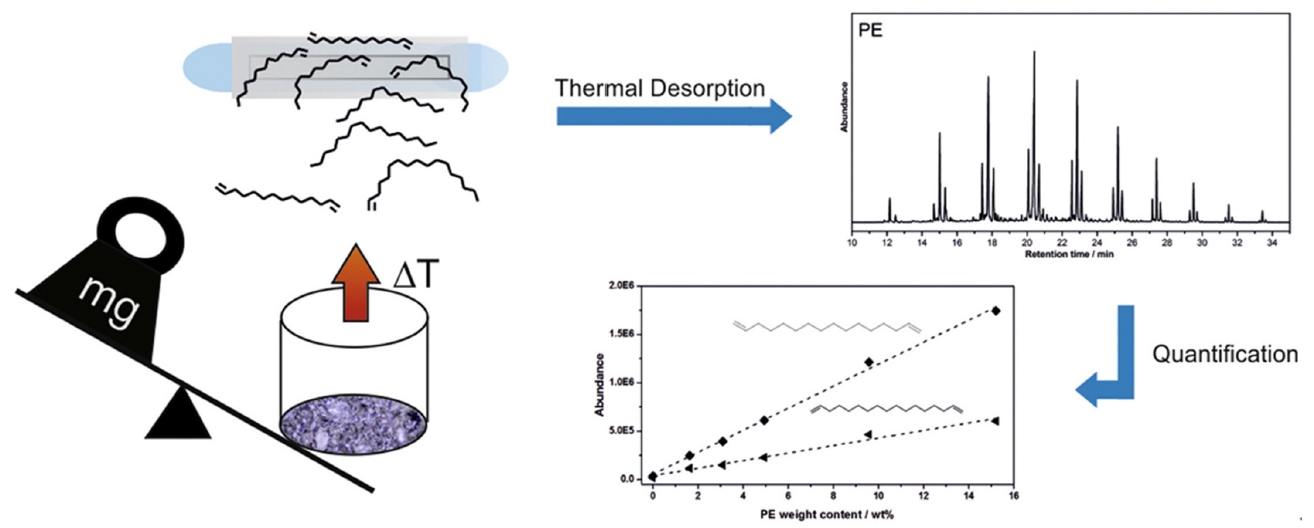
Table 1.
Global prohibitions applicable to products containing microbeads [14].
Table 2.
Recommended water sample volumes in relation to solid content [18].
Table 3.
Separation of polymer types based on solutions used for density separation [19].
Legend: + = separation; ± = possible separation; - = not separated. Polymers: PE = polyethylene; PP = polypropylene; PS = polystyrene; PA = polyamide (nylon); POM = polyoxymethylene; PVA = polyvinyl alcohol; PVC = polyvinylchloride; PMA = poly methyl acrylate; PET = polyethylene terephthalate; PU = polyurethane
Table 4.
참고문헌
1. R. Geyer, J. R. Jambeck, and K. L. Law, “Production, use, and fate of all plastics ever made”, Sci. Adv, 2017, 3, e1700782.



2. 관계부처합동, 제5차 국가환경종합계획(2020-2040), 2020.
3. UNEP, Plastic in Cosmetics, Fact sheet, 2015.
4. International Organization for Standardization (ISO), ISO/TR 21960:2020, Plastics-Environmental aspects - State of knowledge and methodologies, 2020.
5. W. J. Shim, S. H. Hong, and S. Eo, Marine Microplastics: Abundance, Distribution and Composition. Microplastic Contamination in Aquatic Environments, Elsevier, 2018.
6. K. Min, J. D. Cuiffi, and R. T. Mathers, “Ranking environmental degradation trends of plastic marine debris based on physical properties and molecular structure”, Nature Communications, 2020, 11, 727.



7. O. S. Alimi, J. F. Budarz, L. M. Hernandez, and N. Tufenkji, “Microplastics and Nanoplastics in Aquatic Environment: Aggregation, Deposition, and Enhanced Contaminant Transport”, Environ. Sci. Technol, 2018, 52, 1704-1724.


8. EFSA, “Presence of microplastics and nanoplastics in food, with particular focus on seafood”, EFSA J, 2016, 14 (6), 4501.
9. Y. Deng, Y. Zhang, B. Lemos, and H. Ren, “Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure”, Sci. Rep, 2017, 7, 46687.



10. Food and agriculture organization of the united nations (FAO), “Microplastics in fisheries and aquaculture (status of knowledge on their occurrence and implications for aquatic organisms and food safety)”, FAO Fisheries and Aquaculture Technical Paper, 2017, 612.
11. Y. Mato, T. Isobe, H. Takada, H. Kanehiro, C. Ohtake, and T. Kaminuma, “Plastic resin pellets as a transport medium for toxic chemicals in the marine environment”, Environ Sci Technol, 2001, 35, 318-324.


12. I. Velzeboer, C. J. A. F. Kwadijk, and A. A. Koelmans, “Strong Sorption of PCBs to Nanoplastics, Microplastics, Carbon Nanotubes, and Fullerenes”, Environ. Sci. Technol, 2014, 48, 4869-4876.


13. 환경부, 미세플라스틱 규제 관련 국내외 동향 분석, 2019.
14. European Commission, Regulatory Impact Assessment - Microbeads (Prohibition) Bill 2019, 2019.
15. L. Mai, L. J. Bao, L. Shi, C. S. Wong, and E. Y. Zeng, “A review of methods for measuring microplastics in aquatic environments”, Environ Sci Pollut Res, 2018, 25, 11319-11332.

16. D. Elkhatib, and V. O. Craver, “A Critical Review of Extraction and Identification Methods of Microplastics in Wastewater and Drinking Water”, Environ. Sci. Technol, 2020, 54, 7037-7049.

17. 환경부, 미세플라스틱 측정 및 분석의 문제점, 2020.
18. U. Braun, “Principles for the development of standards for investigation procedures of plastics in environmental media and materials”, In: Proposal in the the ISO/TC 61/SC14 WG4; Saitama. 2018.
19. J. C. Prata, J. P. da Costa, A. C. Duarte, and T. R. Santos, “Methods for sampling and detection of microplastics in water and sediment: A critical review”, Trends in Analytical Chemistry, 2019, 110, 150-159.

20. M. G. J. Löder, H. K. Imhof, M. Ladehoff, L. A. Löschel, C. Lorenz, S. Mintenig, S. Piehl, S. Primpke, I. Schrank, C. Laforsch, and G. Gerdts, “Enzymatic Purification of Microplastics in Environmental Samples”, Environ. Sci. Technol, 2017, 51, 14283-14292.

21. U. Braun, “Analytical opportunities and challenges in (ocean) microplastics”, In: ISO TC61/ Annual bioplastics & ocean microplastics symposium; chengdu. 2019.
22. P. M. Anger, E. von der Esch, T. Baumann, M. Elsner, R. Niessner, and N. P. Ivleva, “Raman microspectroscopy as a tool for microplastic particle analysis”, Trends in Analytical Chemistry, 2018, 109, 214-226.

23. C. Zarfl, “Promising techniques and open challenges for microplastic identification and quantification in environmental matrices”, Analytical and Bioanalytical Chemistry, 2019, 411, 3743-3756.


24. A. Käppler, D. Fischer, S. Oberbeckmann, G. Schernewski, M. Labrenz, K. J. Eichhorn, and B. Voit, “Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both?” Anal Bioanal Chem, 2016, 408, 8377-8391.

25. S. C. Lee, and S. J. Oh, “Analysis of Polymeric Materials Using Infrared Microscopy”, Polymer Science and Technology, 2020, 21 (2), 191-197.
26. M. Majewsky, H. Bitter, E. Eiche, and H. Horn, “Determination of microplastic polyethylene (PE) and polypropylene (PP) in environmental samples using thermal analysis (TGA-DSC)”, Science of the Total Environment, 2016, 568, 507-511.

27. J. Yu, P. Wang, F. Ni, J. Cizdziel, D. Wu, Q. Zhao, and Y. Zhou, “Characterization of microplastics in environment by thermal gravimetric analysis coupled with Fourier transform infrared spectroscopy”, Marine Pollution Bulletin, 2019, 145, 153-160.


28. Y. Picó, and D. Barceló, “Pyrolysis gas chromatographymass spectrometry in environmental analysis: Focus on organic matter and microplastics”, Trends in Analytical Chemistry, 2020, 130, 115964.

29. E. Dümichen, A. K. Barthel, U. Braun, C. G. Bannick, K. Brand, M. Jekel, and R. Senz, “Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method”, Water Research, 2015, 85, 451-457.


30. T. Shin, O. Hajime, and W. Chuichi, Pyrolysis-GC/MS data book of synthetic polymers: Pyrograms, thermograms and MS of pyrolyzates, Elsevier, 2011.
31. P. Eisentraut, E. Dümichen, A. S. Ruhl, M. Jekel, M. Albrecht, M. Gehde, and U. Braun, “Two Birds with One Stone-Fast and Simultaneous Analysis of Microplastics: Microparticles Derived from Thermoplastics and Tire Wear”, Environ. Sci. Technol. Lett, 2018, 5, 608-613.

32. E. Düemichen, P. Eisentraut, M. Celina, and U. Braun, “Automated thermal extraction-desorption gas chromatography mass spectrometry: A multifunctional tool for comprehensive characterization of polymers and their degradation products”, Journal of Chromatography A, 2019, 1592, 133-142.


33. M. Pivokonský, L. Pivokonská, K. Novotná, L. Čermáková, and M. Klimtová, “Occurrence and fate of microplastics at two different drinking water treatment plants within a river catchment”, Science of the Total Environment, 2020, 741, 140236.

34. A. K. Baldwin, S. R. Corsi, and S. A. Mason, “Plastic Debris in 29 Great Lakes Tributaries: Relations to Watershed Attributes and Hydrology”, Environ. Sci. Technol, 2016, 50, 10377-10385.


35. L. Su, Y. Xue, L. Li, D. Yang, P. Kolandhasamy, D. Li, and H. Shi, “Microplastics in Taihu Lake, China”, Environ. Pollut, 2016, 216, 711-719.


36. J. Wang, W. Yuan, Y. Chen, and J. Wang, “Microplastics in surface waters of Dongting Lake and Hong Lake, China”, Sci. Total Environ., 2018, 633, 539-545.

37. M. Di, and J. Wang, “Microplastics in surface waters and sediments of the Three Gorges Reservoir, China”, Sci. Total Environ, 2018, 616-617, 1620-1627.

38. L. Lahens, E. Strady, T. C. K. Le, R. Dris, L. Boukerma, E. Rinnert, J. Gasperi, and B. Tassin, “Macroplastic and microplastic contamination assessment of a tropical river (Saigon River, Vietnam) transversed by a developing megacity”, Environ. Pollut, 2018, 236, 661-671.

39. S. Estahbanati, and N. L. Fahrenfeld, “Influence of wastewater treatment plant discharges on microplastic concentrations in surface water”, Chemosphere, 2016, 162, 277-284.


40. E. K. Fischer, L. Paglialonga, E. Czech, and M. Tamminga, “Microplastic pollution in lakes and lake shoreline sediments - a case study on Lake Bolsena and lake Chiusi(central Italy)”, Environ Pollut, 2016, 213, 648-657.


41. T. J. Hoellein, A. R. McCormick, J. Hittie, M. G. London, J. W. Scott, and J. J. Kelly, “Longitudinal patterns of microplastic concentration and bacterial assemblages in surface and benthic habitats of an urban river”, Freshw. Sci, 2017, 36 (3), 491-507.

42. M. Kosuth, S. A. Mason, and E. V. Wattenberg, “Anthropogenic contamination of tap water, beer, and sea salt”, PLoS One, 2018, 13 (4), e0194970.



43. R. Dris, J. Gasperi, V. Rocher, M Saad, N. Renault, and B. Tassin, “Microplastic contamination in an urban area: a case study in Greater Paris”, Environ. Chem, 2015, 12 (5), 592-599.

44. R. Dris, J. Gasperi, V. Rocher, and B. Tassin, “Synthetic and non-synthetic anthropogenic fibers in a river under the impact of Paris Megacity: Sampling methodological aspects and flux estimations”, Sci. Total Environ, 2018, 618, 157-164.


45. M. Lares, M. C. Ncibi, M. Sillanpää; and M. Sillanpää, “Occurrence, identification and removal of microplastic particles and fibers in conventional activated sludge process and advanced MBR technology”, Water Res, 2018, 133, 236-246.


46. K. Magnusson, and F. Noren, Screening of microplastic particles in and down-stream a wastewater treatment plant, IVL Report C55. IVL Swedish Environmental Research Institute, Stockholm, 1-30. 2014.
47. S. A. Mason, V. G. Welch, and J. Neratko, “Synthetic Polymer Contamination in Bottled Water”, Front Chem, 2018, 6, 407.



48. R. Z. Miller, A. J. R. Watts, B. O. Winslow, T. S. Galloway, and A. P. W. Barrows, “Mountains to the sea: River study of plastic and non-plastic microfiber pollution in the northeast USA”, Mar. Pollut. Bull, 2017, 124 (1), 245-251.


49. S. M. Mintenig, M. G. J. Löder, S. Primpke, and G. Gerdts, “Low numbers of microplastics detected in drinking water from ground water sources”, Sci. Total Environ, 2019, 648, 631-635.


50. B. E. Oßmann, G. Sarau; and H. Holtmannspötter, M. Pischetsrieder, S. H. Christiansen, and W. Dicke, “Small-sized microplastics and pigmented particles in bottled mineral water”, Water Res, 2018, 141, 307-316.

51. M. Pivokonsky, L. Cermakova, K. Novotna, P. Peer, T. Cajthaml, and V. Janda, “Occurrence of microplastics in raw and treated drinking water”, Sci. Total Environ, 2018, 643, 1644-1651.


52. M. O. Rodrigues, N. Abrantes, F. J. M. Gonçalves, H. Nogueira, J. C. Marques, and A. M. M. Gonçalves, “Spatial and temporal distribution of microplastics in water and sediments of a freshwater system (Antuã River, Portugal)”, Sci. Total Environ, 2018, 633, 1549-1559.

53. D. Schymanski, C. Goldbeck, H. U. Humpf, and P. Furst, “Analysis of microplastics in water by micro-Raman spectroscopy Release of plastic particles from different packaging into mineral water”, Wat. Res, 2018, 129, 154-162.

- TOOLS
-
METRICS

-
- 2 Crossref
- 7,243 View
- 881 Download
-
Related articles in
J Environ Anal Health Toxicol -
A Short Review on Recent Advanced Oxidation Technologies for Microplastics Degradation2022 ;0(0)
Assessment of Analytical Methods for Formaldehyde in Drinking Water2014 March;17(1)
Review on Analytical Methods for Pharmaceuticals and Personal Care Products2009 June;12(2)