미세플라스틱 제거를 위한 고도산화기술 최신 연구 동향
A Short Review on Recent Advanced Oxidation Technologies for Microplastics Degradation
Article information
Trans Abstract
Microplastics comprise plastic particles that are less than 5 mm in size. Owing to a significant increase in plastic production, micro plastics have become ubiquitous pollutants worldwide. Several studies have reported that microplastics are harmful to living organisms because they can adsorb contaminants from the environment due to their unique physicochemical properties. The adsorbed contaminants on microplastics can be released and accumulated in living organisms, thereby adversely affecting the health of humans and animals. Since existing water treatment technologies as stand-alone processes cannot achieve complete removal of microplastics, reliable methods must be developed. Advanced oxidation processes (AOPs) are a promising approach for the chemical treatment of contaminants such as microplastics. These processes utilize highly reactive oxygen species (e.g., hydroxyl radicals, sulfate radicals, superoxide anions, and singlet oxygen) to decompose microplastics completely. However, at this stage, AOPs can partially degrade and/or alter surface chemistry of microplastics. Therefore, extensive effort must be made to further study AOPs for complete decomposition of microplastics.
1. 서 론
내구성이 좋고 비중이 작으며 가해주는 열과 압력에 따라 가공성이 좋은 제품을 만들 수 있는 플라스틱은 전세계적으로 각광받는 소재로 다양한 분야에 널리 사용되고 있다[1,2]. 플라스틱은 1950 년대 이후 전세계적으로 포장 용기, 자동차, 전자제품 등 현대사회의 광범위한 생활에서 대량으로 사용되고 있다. 하지만 연간 3억톤 이상씩 생산이 증가함으로써[3-5], 이에 따른 폐기물의 양이 해양 쓰레기 비율의 평균 80%에서 95%까지 차지할 정도로 증가하였다[6]. 플라스틱은 시간이 지날수록 물리적 화학적 풍화나 열과 압력 등 자연현상에 의해 분해되는데[7] 이 과정에서 생성된 5 mm 미만의 플라스틱을 미세플라스틱이라고 한다[8]. 많은 연구에서 보고되었듯, 미세플라스틱은 대기, 지표수 및 해양, 식품 등 다양한 영역에서 쉽게 발견되고 있으며 또한 육상에서 해양으로 많이 유입되는 특성 때문에 해양에서 가장 많이 발견된다[9-11].
플라스틱은 산업시대의 경제, 사회적으로 큰 발전을 불러왔지만[12] 동식물 생물체를 비롯해 최종적으로 인간에게 위협이 되고 있다[13]. 미세플라스틱은 또한 최초생산자부터 먹이사슬을 통해 축적되어 상위 생명체에게 전달되어 인간의 건강에 부정적인 영향을 끼치고 있다[13]. 미세플라스틱은 작은 입자특성으로 생물체의 체내로 유입되어 쌓이게 되며, 축적된 미세플라스틱의 독특한 물리화학적 특성 때문에 인간을 비롯한 다양한 생물체에게 유해성이 있다는 연구들이 많이 보고되었다[14-17]. 뿐만 아니라, 플라스틱 제조 과정에서 기존의 플라스틱의 단점을 보완하고 새로운 기능을 부가하기 위해 첨가된 다양한 첨가물이나 유기화합물질(예를 들어 PCBs, POPs 등)들 때문에 이를 함유하고 있는 미세플라스틱들이 체내에 축적된다면 인간 및 동물의 건강에 악영향을 일으킬 가능성이 매우 높다. 따라서 미세플라스틱을 적절하게 제거할 수 있는 기술을 개발하기 위한 많은 노력이 필요하다[18-20].
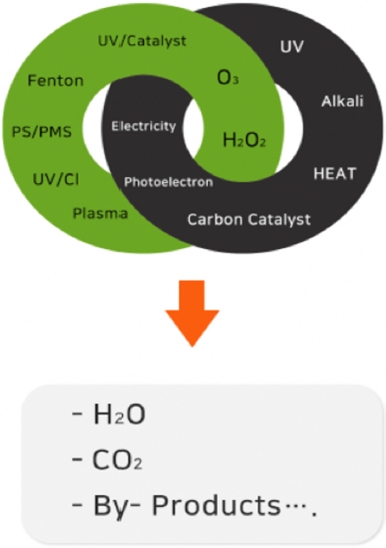
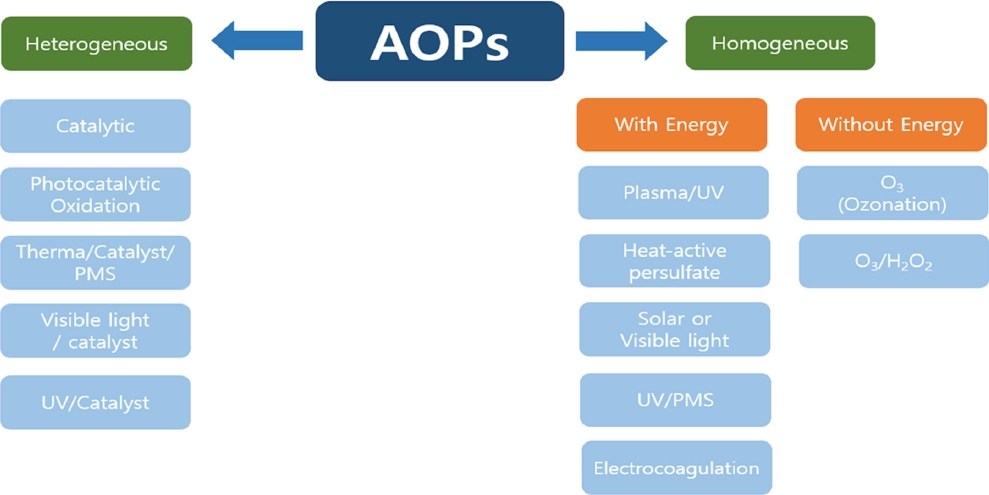
발전하는 도시의 산업화와 인프라로 플라스틱의 발생량이 매우 가파르게 증가함에 따라 미세플라스틱 제거에 관하여 전세계적으로 많은 관심이 증가했다. 하지만 지금까지 알려진 바로는 현재의 정수처리공정으로는 수중 내 미세플라스틱을 완벽하게 제거할 수 없어 미세플라스틱을 포함한 미량오염물질을 완전히 제거하기 위한 처리기술의 개발이 매우 필요한 실정이다[21]. 고도산화공정(AOP)은 미세플라스틱과 같은 난분해성의 미량오염물질을 화학적으로 처리하기 위한 기술이고, 1980 년에는 식수문제를 해결하기 위해 처음 제안되었다. 그 이후에는 폐수 및 하수에 포함되어 있는 다양한 난분해성 오염물질을 제거하기 위한 기술로 도입되었다[22]. 고도산화공정은 다양한 오염물질의 분해를 위해 오존, 펜톤, UV, 촉매 및 산화제 등을 활용하여 수산화라디칼, 황산라디칼 등 다양한 라디칼을 발생하여 사용한다. 지난 수십년 동안 여러 라디칼 중 수산화라디칼 (•OH, Hydroxyl radical, 산화전위: 2.8 V)이 가장 많이 연구되었으며, 현재에도 널리 연구 중이고 활용되고 있는 기술이다[23,24]. 이런 라디칼들의 높은 반응성 때문에 수중에 존재하는 다양한 유기오염물질을 쉽게 분해할 수 있다 (Figure 1) [25,26]. 고도산화공정 중 생성된 라디칼은 미세플라스틱과 같은 유기오염물질을 분해하여 물, 이산화탄소와 같은 분해물질을 생성한다. E. J. Rosenfeldt et al. (2006) 등의 연구에서 현재까지 개발된 많은 고도산화공정 중 hydroxyl radical은 UV/O3, O3, O3/H2, O2, UV/-H2O2 , UV/H2, UV/O3, O2/-O3 등을 포함한 다양한 방법에서 생성되며, 오염물질에 대하여 매우 강한 산화력을 갖는다고 보고하였다[27,28]. 이들 고도산화 공정의 장점으로는 1) 폐수를 처리하는 과정에서 화학적 처리 단계 중 오염물질 간의 교환이 없으며, 2) 환경에 화학적으로 유해한 슬러지를 발생시키지 않고, 3) 고농도의 유기오염물질 뿐만 아니라 난분해성 물질의 분해도 가능하다는 것이고, 이러한 이점들 때문에 최근 난분해성 미량오염물 제거를 위해 활발하게 연구되고 있다[29]. 따라서, 본 논문에서는 최근 보고된 미세플라스틱 제거를 위해 사용된 UV/H2O2, UV/Cl, UV/catalyst, plasma, UV/heat/PS, activated PMS, Heat/catalyst/PMS 등의 고도산화공정(Figure 2)에 관한 연구들을 조사하고, 미세플라스틱에 제거에 대한 각각의 고도산화공정의 특징 및 제거 특성에 관하여 자세히 조사하였다.
2. 균일계 고도산화공정
2.1. UV 공정을 이용한 미세플라스틱 분해
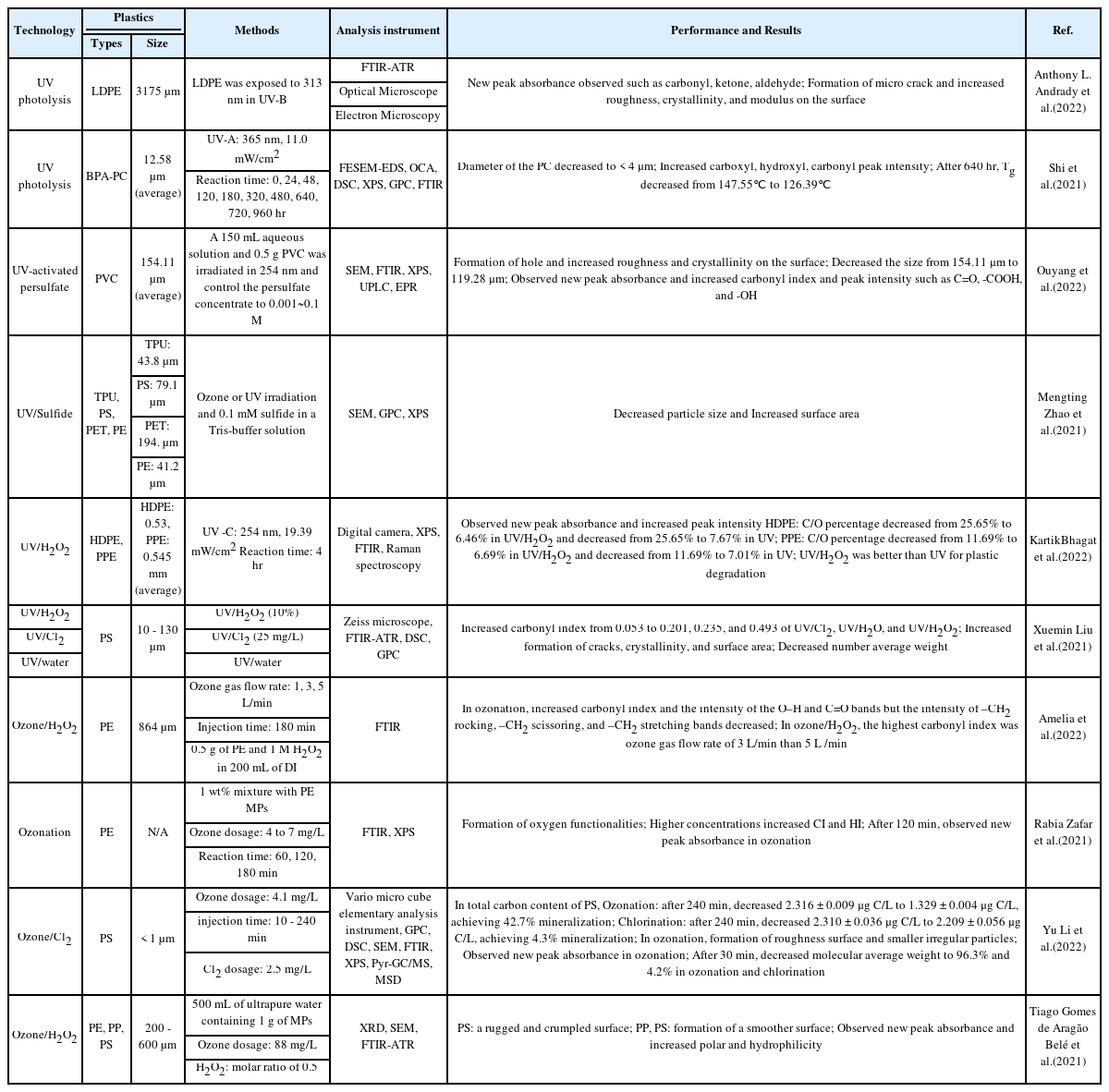
광분해는 광자에 의한 분해반응으로, 특히 UV와 같은 짧은 파장의 빛을 조사하면 광자에 의해 화합물의 결합이 끊어져 더 작은 단위로 분해되는 것이다. 광분해는 빛을 에너지원으로 이용하는 분해방법이기 때문에, 환경에 존재하는 플라스틱의 분해관련 연구가 주로 진행되고 있다[30]. UV 공정을 polyethylene (PE), polystyrene(PS), polyethylene terephthalate (PET), and polyvinylchloride(PVC) 등의 미세플라스틱에 적용하면, 광자와 라디칼에 의한 광분해가 발생하면서 플라스틱 표면에서의 분해와 물리화학적 변형이 발생하는 것을 Table 1을 통해 확인할 수 있다. 또한 미세플라스틱 표면은 광분해에 의한 산화반응으로 균열과 거친 표면을 형성했고, 더 작은 나노 크기의 플라스틱이 발생했다. Andrady et al. (2022)의 연구에서는 200, 375, 500 시간의 UV 노출시간에 따라 PE 표면에서의 변화를 관찰했고, 플라스틱을 절단하여 깊이에 따른 산화정도를 분석했다. 결과적으로 UV에 노출된 시간이 길수록 표면산화에 의한 균열과 거칠기가 증가했다. 하지만 산화에 의한 생성물은 PE 표면으로부터 500 μm 까지 농도가 점차 감소하는 형태로 존재했고, 500 μm 이 후에서는 확인할 수 없었다[31]. 즉, UV에 의한 미세플라스틱 광분해는 표면에만 큰 영향을 미치는 것이다. 광분해에 의한 미세플라스틱 표면에서의 또 다른 변화를 살펴보면, FTIR 분석에서 aldehyde (1,686 cm−1), Carbonyl (1,719 cm−1), ketone (1,733 cm−1) 및 hydroxyl group (3,300 cm−1)과 같은 새로운 피크가 관찰되는 것을 확인ᅠ 할 수 있다[31,32]. 그리고 Shi et al. (2021)의 연구에서는 polycarbonate (PC) 표면에 365 nm의 UV-A를 640 시간 동안 노출하면, 평균 직경이 12.58 μm인 PC 입자의 80% 이상이 직경 4 μm이하로 감소했다[33]. 또한 UV를 이용한 미세플라스틱 분해 연구는 파장에 따라 200 - 280 nm (UV-C), 280 - 315 nm (UV-B), 315 - 400 nm (UV-A)의 범위에서 진행되었고, UV의 파장이 짧을수록 플라스틱 분해가 효과적인 것을 Lin et al. (2020)의 연구를 통해 입증했다[34]. 뿐만 아니라 Lambert et al. (2016)에 의해 수행된 연구에서는 PS를 UV에 노출하는 시간이 길수록 나노 크기의 PS 입자 형성이 증가하는 것을 확인했다[35]. 따라서, UV 공정은 파장이 짧고 노출된 시간이 길수록 광분해에 의한 미세플라스틱 분해가 효과적인 것을 알 수 있지만, UV 광분해에 의한 미세플라스틱 분해는 표면에만 제한적으로 영향을 미치며, 나노 크기의 플라스틱이 형성되므로 이를 해결할 추가적인 방법을 모색해야할 것이다.
2.2. UV/H2O2 공정을 이용한 미세플라스틱 분해
광분해에 의해 생성되는 반응성 중간체와 라디칼 종류에는 hydroxyl radicals (•OH), triplet organic matter (3OM•), singlet oxygen (1O2), hydrated electrons (e−aq), superoxide radical anions (O2•−), carbonate radicals (CO3•−), and organoperoxy radicals (ROO•) 등이 존재한다. 이 같은 반응성 중간생성물과 라디칼은 높은 산화력으로 원자 간의 결합을 끊어 복잡한 구조의 분자를 분해하는 능력을 가지고 있다. 수은램프를 활용한 UV/H2O2 공정은 Tian (1910년)에 의해 연구된 것으로, 215 - 375 nm 파장의 빛을 H2O2가 흡수하면서 라디칼을 생성하는 원리이다. 아래의 반응식 (식 1(1) - (3))을 거쳐 생성된 •OH와 HO2•는 원자 간의 결합을 끊어 물질을 분해하거나 H2O2와 반응하여 O2•−, HO2•, O•−와 같은 새로운 라디칼을 연쇄적으로 생성할 수 있다. 따라서 UV/H2O2는 강한 산화력을 가진 라디칼을 바탕으로, 구조가 복잡한 난분해성 물질을 분해하는 공정으로 활용되고 있다[36].
H2O2 + hv → 2 •OH(1)
H2O2 + hv → H2O + 1/2 O2(2)
H2O2 + hv → HO2• + •H (3)
Bhagat et al. (2022)의 연구에서는 UV 광분해와 UV/H2O2를 이용하여 high density polyethylene (HDPE)과 polypropylene (PP) 분해를 비교하는 연구를 진행했고 표면의 물리화학적 특성 변화, Carbonyl index (CI), XPS를 활용한 탄소 (C)와 산소 (O)의 원소 함량을 분석했다. UV 광분해와 UV/H2O2 처리 모두 HDPE와 PP의 표면 산화가 진행되었고, FTIR 분석에서 carbonyl groups과 ester 피크가 형성되고 증가했다. 이에 따라 HDPE와 PP의 CI는 각각 0.05에서 0.3, 0.02에서 0.11로 증가했다. 그리고 각 공정을 4 시간동안 처리한 후 HDPE와 PP의 원소함량을 분석한 결과, UV/H2O2에서 HDPE의 C/O비는 25.65에서 6.46으로 감소했고 PP는 11.69에서 6.69로 감소했다. UV 광분해의 경우에는 HDPE의 C/O비가 7.67로 감소했고 PP는 7.01로 감소했다. 결과적으로 CI와 C/O비의 변화를 통해, UV 광분해보다 UV/H2O2가 HDPE와 PP 분해를 더 효과적으로 진행한 것을 입증했다[37]. 또한 Liu et al. (2021)의 연구에서는 UV/H2O2, UV/Cl2, UV/H2O를 활용한 PS 분해 연구가 진행되었고, PS에서 거친 표면 및 극성작용기의 형성과 결정성, 비표 면적, CI의 증가를 확인했다[38]. UV/Cl2과 UV/H2O 또한 Cl•, Cl2•− 및 •OH 라디칼을 형성하여 UV/H2O2같이 효과적인 PS 분해가 진행되었지만 UV 광분해에서 언급된 것처럼 대부분 미세플라스틱의 표면산화만 진행되어, 완전한 분해까지는 오랜 시간이 소모될 것이다.
2.3. 오존처리를 이용한 미세플라스틱 분해
오존은 세 개의 산소원자로 구성된 동위원소로, 화학적으로 매우 불안정한 상태로 존재하기 때문에 아래의 반응식을 거쳐 손쉽게 라디칼을 생성한다. 오존과 생성된 라디칼은 강한 산화력과 높은 반응성을 띄기 때문에 오염 물질을 처리하는 공정으로 활용되고 있고 환경처리시설에서 광범위하게 사용되고 있다. 아래는 오존의 라디칼 생성 과정을 나타낸 식이다 (식 (4)~(9)) [36].
OH− + O3 → HO2− + O2(4)
OH− + O3 → HO4−(5)
HO4− ↔ HO2•−+ O2•−(6)
O2•− + O3 → O2 + O3•−(7)
O3•− → O2 + O•−(8)
O•− + H2O → •OH + OH−(9)
오존처리를 통한 미세플라스틱 분해 연구는 플라스틱 표면변화를 모니터링했고, 플라스틱 분해와 구조변화를 분석했다. Amelia et al. (2022)에 의해 수행된 연구에서는 오존의 주입량이 많을수록 PE의 O-H (3,600 cm−1), C = O (1,715 cm−1)의 피크 세기 증가와 −CH2 rocking (718 cm−1), −CH2 scissoring (1,468 cm−1), −CH2 stretching (2,840, 2,910 cm−1) 피크 세기 감소를 통해 오존처리에 의한 PE의 표면산화를 분석했다[39]. 또한, Zafar et al. (2021)의 연구에서는 오존 처리 이후에 PE 표면에서 C-O (1,030 cm−1), R-CHO with intermolecular H-bond (1,652 cm−1), R-CO-OR (1,683 cm−1), RC(=O)R (1,720 cm−1) 피크가 새롭게 관찰되었고, CI와 Hydroxyl Index(HI) 증가를 통해 PE 표면의 구조적 변화를 확인했다[40]. Li et al. (2022)의 연구에서는 PS 분해를 위해 오존과 염소처리를 진행했고, PS의 표면변화와 물리화학적 특성 변화를 분석했다. 상대적으로 오존처리가 염소처리보다 PS의 무게 평균 분자량 (MW), FTIR 분석, 유리전이온도 (Tg)에 더 큰 변화를 가져왔고, 이를 통해 오존처리가 PS분해에 더 큰 영향을 미친다는 것을 증명했다. PS의 무게 평균 분자량은 30 분의 오존처리 이후에 96.3% 감소했고, 염소 처리는 4.2% 감소했다. 또한 앞서 언급된 내용과 동일하게 오존 처리된 PS에서는 새로운 피크가 관찰되었지만 염소 처리된 PS에서는 피크의 변화가 관찰되지 않았다. 그리고 일반적으로 플라스틱의 무게 평균 분자량이 감소하면 유리전이온도가 감소하지만, 오존 처리된 PS는 무게 평균 분자량의 감소에 의한 유리전이온도의 감소보다 표면에 새로운 극성작용기 형성에 의한 영향이 더 크게 작용되면서 유리전이온도가 증가했다. 이와 달리 염소 처리된 PS의 유리전이온도는 변화가 없는 것으로 확인됐다[41]. 또한 Belé et al. (2021)의 연구에서는 단일 오존처리와 오존/H2O2를 이용한 미세플라스틱 분해를 비교하는 연구가 진행되었는데, 단순 오존처리의 경우, 1 L/min, ᅠ3 L/min, 5 L/min의 오존 가스 유입량에서 오존 가스의ᅠ 주입량이 많은 5 L/min에서 플라스틱 분해효율이 좋았으 나, 오존/H2O2를 이용할 때에는 3 L/min에서 효과적인 것으로 확인됐다. 5 L/min의 단일 오존처리에서는 PE 표면에서 가장 많은 극성작용기 형성과 CI의 변화를 보였지만, 3 L/min의 오존/H2O2 처리에서 가장 효과적인 것으로 확인했다[42]. 이처럼 오존처리는 미세플라스틱 분해에 활용될 수 있지만, UV 공정과 마찬가지로 표면에만 큰 영향을 주어 별도의 추가적인 전처리 혹은 후처리가 필요할 것으로 생각된다.
3. 비균일계 고도산화공정
유기화합물과 난분해성 물질은 광화학 반응에 의해 산화/분해되며 이를 위해 가시광선과 UV 활성 광 촉매가 광범위하게 사용된다. 광 촉매는 빛에너지가 촉매에 조사되면 가전자대에서 전도대로 전환되며 이때 촉매 표면에서 •OH 혹은 O2•−의 활성산소종이 형성되어 대상 물질을 산화시킨다. 광촉매의 오염물질 제거 매커니즘은 다음과 같다(식. (10)~(13)) [36].
O2 + e−CB → O2•−(10)
H2O + h+VB → •OH + H+ (11)
O2•− + Pollutants → H2O + CO2 (12)
•OH + Pollutants → H2O + CO2 (13)
대표적인 광 촉매로 TiO2, ZnO가 사용되며 이들 광원의 흡수도를 효율적으로 높이기 위한 다양한 연구가 행되고 있다. 난분해성 오염물질인 미세플라스틱 혹은 노플라스틱의 분해를 위해 광촉매법을 이용한 선행연구의 방법과 결과를 광촉매/가시광선, 광촉매/UV 공정 두 개의 세션으로 구분하여 기술별로 문헌을 검토하고 평가하였다(Table 2).
3.1. 광촉매/가시광선 공정을 활용한 미세플라스틱의 분해
먼저 광촉매법을 활용한 미세플라스틱 분해의 해외 연구 사례에서 가시광선과 태양광을 사용한 문헌이다. Cao et al. (2022)의 연구에서는 PET을 대상으로 연구하였고 사용된 촉매는 MXene/ZnxCd1-xS를 사용했다[43]. 이 촉매의 합성 조건은 Zn과 Cd의 몰비 (x = 0, 0.2, 0.4, 0.5, 0.6, 0.8, 1.0)와 ZxC1-xS에 대한 MXene의 질량비 (1, 2, 3, 5%; M-1/ZxC1-xS, M-2/ZxC1-xS, M-3/ZxC1-xS, M-5/ZxC1-xS)로 구분하여 평가하였다. 다른 연구와 구분되는 점은 광촉매뿐만 아니라 H2 evolution reaction의 혼합 공정으로 PET의 분해에 대한 연구를 수행하였으며 동시에 분해에 사용되는 에너지 문제 해결을 위한 지침을 제공하였다. 촉매 중 가장 미세플라스틱의 분해 효과가 좋았던 실험 조건은 가시광선 조사 조건하에 50 mL의 PET ᅠ 용액을 대상으로 평가 수행되어 M-2/Z0.6C0.4S의 경우가 14.17 mmol·g-1·h-1의 photocatalytic H2 evolution 발생ᅠ 속도를 나타냈으며 가장 뛰어난 고효율의 촉매 활성을 보였다. 이것은 M-2/Z0.6C0.4S의 향상된 전하-정공 분리 효율과 증가된 가시광선 흡수 능력 및 적절한 산화 전위의 시너지 효과로 얻은 결과이다. H NMR 분광법으로 분석한 결과 120 mL의 10 M NaOH 수용액과 3 g의 PET에서 에틸렌 글라이콜과 소량의 테레프탈산이 주로 분해되어 포름산염, 메탄올, 아세트산 및 에탄올 등과 같은 유기화합물로 산화됨을 관찰하였다.
Vital-Grappin et al. (2021)의 연구에서는 HDPE를 대상으로 가시광선과 C, N-TiO2를 이용해 미세플라스틱의 분해 연구를 수행하였다[44]. 이 문헌에서는 미세플라스틱의 광촉매 분해가 일어날 때 •OH 자유 라디칼, H+, O2•−, e-가 미치는 영향에 대한 각각의 실험을 진행하였다. 각 평가 항목에서 제거제의 유무 조건에 따른 미세플라스틱 분해 효과에 대한 평가를 수행했다. 평가 항목 중 •OH 자유 라디칼의 경우 분해 시스템에 •OH 자유 라디칼이 존재할 때가 그렇지 않을 때와 비교했을 때 미세플라스틱의 농도가 71.77% 감소하는 결과를 나타내어 대부분의 분해는 •OH 자유 라디칼에 의해 일어난다는 결과를 제시했다. 그 밖의 항목들의 평가 이후 결과적으로 미세 플라스틱 분해를 위한 광촉매 반응 시스템은 특정 특성에 큰 영향을 받는 복잡한 반응임을 확인하였으며 광발생에 의해 생성된 e-가 환원을 억제하기 때문에 광촉매 분해에 필수적인 역할을 하는 것으로 나타냈다.
Jiao et al. (2020)의 연구에서는 PE, PP, PVC를 대상으로 가시광선과 Nb2O5를 사용하여 미세플라스틱 분해에 대한 실험과 분해 메커니즘에 대해 연구했다[45]. 위 플라스틱은 분해 후 CO2, CH3COOH 및 미량의 CO가 검출되었으며 이 중 생성된 CO2의 총 탄소 몰수는 첨가된 순수한 PE, PP, PVC의 총 몰수와 거의 같았고 이는 플라스틱이 최종 분해 후 CO2로 완전히 광분해 된다는 것을 나타냈다. PE, PP, PVC는 각각 동일한 실험 조건에서 40, 60, 90 시간 내에 100% 광분해 되었다. 또한 PE, PP, PVC로 구성된 실제 일회용 봉투, 용기, 랩 등의 분해를 통해 CH3COOH 발생량이 점점 증가하는 것도 확인하였으며 이는 실제 산업 플라스틱의 분해 후 CO2가 선택적으로 CH3COOH로 추가 광환원 될 수 있음을 나타냈고 산업 플라스틱의 첨가제에 의한 것일 수 있음을 시사했다.
Tofa et al. (2019)의 연구에서는 LDPE 필름을 대상으로 가시광선과 ZnO를 사용하여 연구하였으며 ZnO와 백금이 증착된 Pt-ZnO 광촉매의 분해 효율 비교를 수행했다[46]. 백금 나노 입자의 증착 후 Pt-ZnO nanorods의 표면의 형태가 거칠어졌으며 300 - 750 nm의 흡광도 스펙트럼에서 Pt-ZnO의 가시광선 흡수량이 78% 향상됨을 확인하였고 또한 백금이 전자-정공 재결합을 감소시키는 것을 확인했다. 이 결과로 미세플라스틱의 광촉매 분해시 LDPE 필름이 ZnO을 사용했을 때 보다 Pt-ZnO를 사용하였을 때, 카르보닐 지수와 비닐 지수를 계산하여 분해 정도를 간접적으로 정량화한 결과, 각각 미세플라스틱의 분해가 13%, 15% 증가함을 확인했다. 이 문헌에서는 광촉매를 이용한 LDPE 필름 분해율에 대한 연구가 부족했던 점이 아쉬웠지만 미세플라스틱 문제를 해결하기 위한 나노 복합 광촉매 연구를 수행했다는 점이 평가할 만했다.
이 세션의 마지막으로 Lam et al. (2021)의 연구에서는 200 mg의 LDPE을 Fe-ZnO 분말 10 mg과 합성하여 LDPE/Fe-ZnO 필름을 제조하였고 Fe가 도핑되지 않은 ZnO도 마찬가지로 사용하여 LDPE/ZnO 필름을 제조했다[47]. 위 문헌들과 다르게 이 문헌에서는 제작된 필름을 30 일동안 야외에서 271.6 W/m2 태양광으로 조사하였고 비교를 위해 57 W/m2의 가시광선을 조사하여 LDPE 필 름의 중량 손실을 측정하였다. 결과적으로 순수 LDPE 필름은 태양광 조사 조건에서 6.1%의 중량 변화를 보였고 LDPE/ZnO의 경우는 16.1%, LDPE/Fe-ZnO의 경우는 120 시간 후 41.3%의 중량 감소를 보였다. 또한 Fe가 도핑된 ZnO의 경우 빛의 종류와 상관없이 광활성이 개선되었음을 나타냈다. 광분해 후 LDPE/ZnO (Fe-ZnO) 필름의 표면은 순수 LDPE필름 보다 깊은 균열이 발생하여 ZnO 나노입자 근처에서 활성 라디칼을 생성함을 발견했다.
3.2. 광촉매/UV 공정을 활용한 미세플라스틱의 분해
다음은 광촉매법을 활용한 미세플라스틱 분해의 해외 연구 사례에서 UV를 사용한 문헌이다. Domínguez-Jaimes et al. (2021)의 연구에서는 PS를 나노플라스틱(NP) 크기로 제조하여 이를 대상으로 분해 실험을 수행했으며 TiO2는 TiO2/B (barrier structure), TiO2/T (nano-tubular), TiO2/M (mixed structure) 3가지의 다른 구조로 제조 되었으며 촉매와 단순 UV light의 광분해 효율을 비교 분석하였다.48) 실험 전, 후의 PS-NP의 분해, 무기화 변화를 관찰하였고 결과적으로 UV 광분해, TiO2/B, TiO2/T 그리고 TiO2/M는 각각 16.1%, 16.2%, 19.7%, 23.5%의 나노플라스틱 제거효율을 보였다. 광분해 후 PS-NP의 산화 지표로서 카보닐기 형성을 보였으며 오염물질 농도도 최적의 조건에서 23.5% 감소하였다. 문헌 결과에 따라 광촉매의 구조적 제조방식에 따른 플라스틱, 유해 오염물질 등의 분해에 대한 연구 확산이 기대된다.
Fadli et al. (2020)의 연구에서는 PE를 대상으로 분해 실험을 수행했으며 TiO2에 Ag와 Reduced graphene oxide (RGO)를 합성하여 Ag/TiO2와 Ag/TiO2/RGO 촉매를 제조하고 UV 조사하여 실험했다. 50 mg의 미세플라스틱을 100 mL 초순수에 넣고 Ag와 RGO가 합성되지 않은 TiO2와 Ag/TiO2, Ag/TiO2/RGO를 각각 50 mg씩 첨가하여 4 시간 동안 분해실험을 진행했고 최종적으로 각각 56%, 68%, 76%의 분해율을 얻었다[49]. TiO2/UV 공법의 미세플라스틱 분해에 대한 효율과 개선된 촉매 제조의 분해 효율 향상에 대한 결과를 보였다.
Allé et al. (2021)의 연구에서는 PS와 PMMA를 대상으로 분석 실험을 수행했으며 공정 조건에서 유량, 초기 pH, 빛의 세기, 미세플라스틱의 구조와 입자 크기에 대한 영향을 파악했다[50]. 유량은 유속이 높을수록 운동속도 상수에 영향을 미쳐 TOC 전환이 낮아지는 결과를 보였고 초기 pH값은 4-6 범위, 빛의 세기는 56 W/m에서 112 W/m로 증가할 때 TOC 전환이 높아졌다. 화학 구조와 입자크기에 따른 결과로는 PMMA의 C=O 및 C-O 결합이 PS의 C-C, C=C 및 C-H 결합에 비해 깨지기 쉬워서 TOC 전환이 더 잘되었고 입자의 크기는 작을수록 접촉 면적이 커져 TOC 전환이 더 잘되었다. 최종적으로 TiO2-P25/β-silicon carbide alveolar foams와 112 W/m2 UV, 10 mL/min의 유속과 6.3의 초기 pH 값 조건에서 처리하였을 때 PMMA의 경우 공정 7 시간 후 TOC 전환이 50%에 달하는 결과를 나타냈다. 이 문헌에서는 PS, PMMA의 분해 비교실험을 통해 다양한 분자구조에 대한 미세플라스틱 분해의 공정 효율을 보여준 점이 우수했고 공정의 최적화 조건과 저하 조건을 이해해야 함을 기술했다.
Razali et al. (2020)의 연구에서는 PP를 25, 100 mm2 으로 잘라서 제조했다. ZnO 촉매와 제조된 미세플라스틱을 UV로 조사하여 50oC 조건에서 실험을 수행하였다[51]. SEM으로 PP 표면을 관찰했을 때 35oC에서 3 g/L ZnO가 사용되었을 때 PP 표면에 작은 균열과 3 μm이하의 구멍 이 관찰되었고 50oC에서 1 g/L ZnO를 사용했을 때 전체적인 PP표면이 거칠어졌으며 균열이 더 커졌으며 구멍도 15 μm이상으로 증가했다. 이러한 현상은 폴리머 분해를 나타낸다. 최종적으로 PP 입자의 25 mm2 면적은 50oC에서 1 g/L의 ZnO를 사용하여 분해하였을 때 7.89%의 감소를 보였으며 이는 반복 공정을 수행하였을 때 더욱 감소하여 최종적으로 5 번의 공정 이후 38%까지 면적 감소가 나타났다. 이 문헌에서 미세플라스틱 분해를 위한 공정에 온도의 증가와 공정 횟수 증가가 분해능에 좋은 영향을 미친 것으로 나타났으며 공정 개선에 기여한 점이 돋보였다.
Wang et al. (2019)의 연구에서는 미세플라스틱 분해를 위한 실험에 사용된 미세플라스틱으로 생활용품과 강, 바다에서 추출된 PS를 여과했다[52]. TiO2 입자 (700 nm)는 가수분해 및 축합 반응을 통해 합성한 후 촉매 표면에 열 증착을 통해 먼저 Ni (또는 Fe)을 10 nm을 증착하고 그 다음 Au 30 nm를 증착하여 광촉매를 제조하였다. 이 문 헌에서는 기존의 광촉매 반응을 기반으로 하며 UV를 조사했을 때 효율적으로 움직이는 마이크로모터를 물과 묽은 과산화수소 용액에서 독립적으로 작동하게 하여 실제환경에서 미세플라스틱의 제거가 가능하도록 하는 시스템을 구현했다. 마이크로모터의 속도는 UV 조사 하에 물과 과산화수소에서 각각 14.72 μm/s, 65.52 μm/s를 보였고 결과적으로 물과 과수가 담긴 용액에서 미세플라스틱이 정량적으로 각각 67%, 71%의 제거가 가능하도록 했다. 이 연구에서는 앞선 연구들과는 다른 새로운 기술 중 하나인 마이크로모터에 관한 연구로 학문과 기술적으로 환경 내 미세플라스틱 제거를 위한 여러 대안을 제시했다.
4. 기타 고도산화공정
미세플라스틱 제거에 주로 활용된 균일계 고도산화공정과 비균일계 고도산화공정 이외의 기타 고도산화공정으로는 자외선/열을 이용한 고도산화공정, 열/촉매를 이용하여 peroxymonosulfate을 활성화하여 사용한 고도산화공정, 플라즈마 기반 고도산화공정이 있었으며, 각 기술의 특징 및 미세플라스틱 제거 특성은 아래와 같으며, Table 3에 자세하게 정리하였다.
4.1. 자외선/열을 이용한 고도산화공정
UV/heat 과황산염 처리기술은 황산염 라디칼이 과산화물 결합의 균일하게 끊어지며 과산화 이중황산염이 생성되어, 이러한 반응을 일으키기 위해 에너지원으로 자외선 조사 및 열을 이용한다. 열을 이용하는 경우 30oC에서 O-O 결합이 끊어지기 시작하며 90oC에서는 반응이 빠르게 진행된다. UV 조사의 경우 248~254 nm에서 황산염의 광분해로 인한 높은 라디칼 양자 생산성을 나타내며, 이를 이용한 오염물질을 분해가 진행된다. UV/heat에 의한 황산염 라디칼 반응식은 다음과 같다[21,53].
S2O82− + heat/hv → 2SO4•− (14)
S2O82− + H2O → 2SO42− + •OH + H+ (15)
S2O82− + OH− → SO42− + •OH (16)
2S2O82− + 2H2O → 3SO42− + SO4•− + O2•− + 4H+ (17)
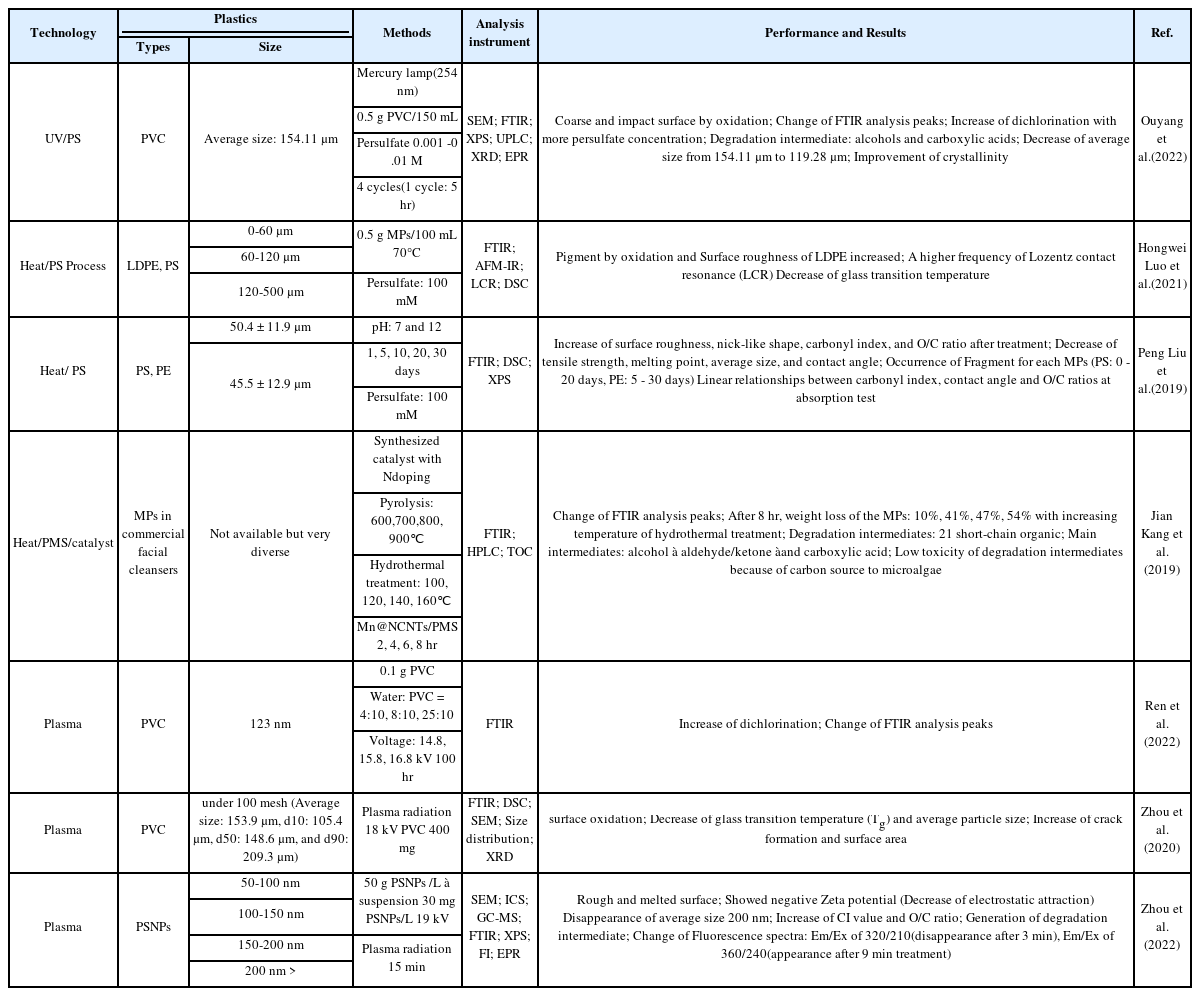
Ouyang et al. (2022)의 연구에서는 PVC 분말(0.5 g/L)을 이용하여 과황산염 라디칼의 농도를 0.001 - 0.01 M 로 증가시키며 PVC에 관한 분해실험을 진행하였다[53]. 과황산염 라디칼의 농도가 증가할수록, PVC에 탈염소화로 인하여 방출되는 염소의 양이 증가하였으며 그 방출되는 염소농도는 31.486 ± 2.915 mg/L에서 99.831 ± 10.731 ᅠmg/L 로 증가하여 높은 농도의 황산염 농도가 PVC의 강한 산화력을 나타냈다. PVC의 평균 직경은 154.11 μm에서 119.28 μm으로 감소하였으며, 초기 130 μm이상의 PVC는 91.7%를 차지하였고, 150 μm이상은 66.6% 로 감소, 35 시간의 자외선 조사 실험이후 130 μm이하의 ᅠPVC는 66.7%, 150 μm이상은 8.3%로 변화한 결과가 나타났다. 또한, FTIR 분석결과 C-H, C-Cl, CH-Cl의 피크 감소가 발생하였으며, C=O, −COOH, −OH에 해당하는 피크의 세기가 두드러지게 증가하였다. 마찬가지로, XPS 분석결과에서 C-O, C=O 피크의 증가, O/C ratio 증가, Cl 2p1/2 및 Cl 2p3/2 피크의 감소가 일어났으며, UPLC 분석 결과 또한 C=O, −OH, −COOH가 포함되는 알코올과 카복실산이 생성되었다. 더하여, Liu et al. (2019)의 연구에서는 과황산염 라디칼을 70oC에서 100 mM를 첨가하여 PS, PE 구형입자를 1, 5, 10, 20, 30 일 동안의 분해실험을 진행하였다. 10 일 분해 실험 이후, PS 와 PE 입자의 표면에 균열이 발생하며 거친 표면이 생성되었다[54]. 30 일 이후에는 50.4 ± 11.9 μm의 직경을 가진 PS 입자와 45.5 ± 12.9 μm의 직경을 가진 PE 입자의직경의 변화가 발생하였다. PS의 경우 모든 PS입자가 30 μm이하가 되었으며, PE 입자의 경우 20 μm이하의 직경이 97.4%를 차지하였다. 위의 Ouyang의 결과와 마찬가지로 FTIR에서 O의 함유한 기능기의 피크의 증가, XPS에서의 O함유의 peaks의 증가, O/C ratio의 증가, 녹는점의 감소 등이 발견되었다. 이 연구결과에서 흥미로운 점은 CI index 그리고 O/C ratio는 CIP 흡착등온식에서 선형적인 관계를 가졌다는 것이다.
4.2. 열/촉매를 이용한 peroxymonosulfate 활성화
PMS (HSO5-)는 산화제로 널리 사용되며, 이를 활성화 시키기 위하여 열, 촉매, 자외선 조사 등을 이용하여 고도산화처리에서 강한 산화력을 가진 SO4•− 과 •OH가 동시에 생성시켜 오염물질을 분해에 효과적이며 오염물질을 처리하기 위해 광범위하게 연구가 이루어지고 있다. 밑의 반응식은 PMS로 인한 라디칼 생성 반응식이다.
HSO5−/ SO5− + heat/hv → SO4•− + • OH (18)
Mn+ + HSO5- → Mn+1 +•OH- + SO4•- (19)
Mn+ + HSO5- → Mn+1 + OH + SO42- (20)
Kang et al. (2019)의 연구에서는 Mn@NCNTs 촉매와 PMS를 이용하여 세안용 제품 4 개를 미세플라스틱에 대한 분해실험을 진행하였다[55]. 촉매합성에 이용된 열수작용의 온도가 100, 120, 140, 160oC 로 상승시킬수록 미세플라스틱의 질량 손실이 각각 10%, 41%, 47%, 54%로 증가하는 결과를 얻었으며, 원인으로 N 도핑 인한 금속의 봉지(encapsulation)효과와 합성된 Mn@NCNT 촉매가 기존 CNTs 및 NCNTs 보다 낮은 활성화에너지 때문이라고 보고하였다. HPLC분석결과에서는 21 개의 짧은 고리를 가진 유기물과 3 개의 기능기 (알코올, 알데히드/케톤/카복실산)들이 높게 검출되었다. 반응 6 시간까지는 알데히드 및 케톤과 같은 중간생성물이 형성되며, 8시간이후에는 카복실산이 가장 지배적인 것으로 확인하였다. Liu 연구진은 200 - 400 mesh 크기의 PA6, PS를 각각 0.5 g, 19.7 mL의 초순수, 0.913 g의 PMS, 0.2 M Fe2+ 용액 0.3 mL을 혼합하여 1 회당 5 시간씩 총 4회 펜톤과 PMS를 이용한 미세플라스틱 분해실험을 진행하였다[54]. XPS 분석결과, PA6는 초기 O와 C의 함유량은 11.03 ± 0.01%, 77.80 ± 0.33%에서 실험 횟수가 증가될수록 O의 함유량은 증가하며 반면에 C의 함유량은 감소하여 4 회 실험 후 각각 18.50 ± 0.04, 72.83 ± 0.62으로 변화하였으며, PS의 경우 PA6와 비슷하게 초기 O와 C의 함유량은 11.02 ± 0.06%, 77.62 ± 0.41%에서 4 회 실험 후 각각 17.31 ± 0.05%, 72.72 ± 0.54%를 포함하였다. 이와 비슷하게 FTIR 분석결과 C=O, O-C=O의 피크가 강하게 생성되었다. PA6는 아마이드가 나타내는 1,293 cm−1, 1,533 cm−1, 3,078 cm−1, 3,293 cm−1가 소실되었고, Raman 분석에서도 아마이드가 분해되며 980 – 1,050 cm−1, 3,050 cm−1에 해당하는 피크가 생성됨을 확인하였다. 실험횟수가 증가할수록 펜톤과 PMS에서 공통적으로 O/C ratio, 미세플라스틱의 질량 감소, 중간생성물 (PA6: 에스터기, PS: 알코올, 케톤, 알데히드)가 관찰되었다. 펜톤과 PMS의 차이점은 PMS가 수산화 라디칼보다 강한 산화력을 가지고 있기 때문에, PMS를 적용한 실험에서 미세플라스틱의 물리화학적 변화가 두드러진 결과를 얻었지만, 수산화 라디칼을 활성산소종으로 사용하는 펜톤의 경우 수산화기 피크가 FTIR에서 높게 검출되었다.
4.3. 플라즈마
전기 방전 플라즈마 자외선 조사 및 화학적 산화와 같이 친환경적인 기술이며, 플라즈마 분해 기술은 주로 DBD (Dielectric barrier discharge) 반응기를 이용하여 강한 전기장의 조건을 이용하여 자유 전자(e−)를 생산한다[56]. 이러한 자유전자는 반응 포텐셜은 −2.9 V을 가지고 있어, 오염물질을 효과적으로 분해할 수 있는 •OH, •H와 같은 다양한 활성산소종을 생성한다[56]. 자유전자로 인한 활성산소종의 반응식은 밑의 식에 나타나 있다.
E−aq + •OH → H2O + OH- (21)
e− + H2O → •OH + •H + e− (22)
O2• + O3− → O2 + O3•− (23)
O3•− + H+ → HO3• (24)
HO3• → •OH + O2 (25)
Ren et al. (2022)의 연구에서는 플라즈마의 전압과 물과 PVC의 비율을 변화시켜가며 PVC 제거에 관한 실험을 진행하였다[56]. 가해지는 전압을 14.8 kV, 15.8 kV, 16.8 kV로 증가시켰을 시, 각 전압에 따른 제거율 65.3%, 81.7%, 85.9%로 나타났으며, 평균 직경이 123 nm에서 ᅠ52 nm로 감소한 결과가 나타났다. 15.8 kV이상이 되었을 때는 과한 활성산소종으로 인하여 제거효율이 상대적으로 상승하지 않았다. 또한, 물과 PVC의 비율을 4:10, 8:10, 25:10 로 적용하였을 때에는 85.9%, 74.1%, 70.9% 의 차이를 보였다. 물의 함량이 4:10일시 높은 제거율을 보인 반면, 물의 함량이 증가할수록 제거율이 감소하는 이유는 이러한 결과는 물이 첨가됨으로써 방전 영역에서의 추가적인 활성산소종의 생성과 일부 PVC 분말이 플라즈마의 강한 충격파로 인하여 방전영역을 벗어나 활성산소종의 반응이 감소 때문이다. Zhou et al. (2020)의 연구에서는 다른 PVC의 플라즈마 분해에 관한 연구에서 PVC 플라즈마 처리 후, 탈염소화로 인한 FTIR의 C-Cl 피크의 감소와 C-O, C=O 해당하는 피크의 증가로 인한 결정성증가 및 표면의 거칠기 변화 그리고 질량 손실과 녹는점의 감소를 관찰하였다[57]. Zhou et al. (2020)의 또다른 연구에서는 PS (Polystyrene)의 나노 입자를 플라스마 처리하였으며, 플라즈마로 인한 활성 산소종으로 인하여 C-C 처음 결합이 끊어지는 사슬 절단현상 이후 가교현상과 단계적 연쇄반응을 보고 한 바 있다[58]. 이로 인한 O/C ratio의 증가, FTIR의 피크의 변화, PS의 분해과정에서의 다양한 중간생성물의 생성 및 분해를 나타냈다. 연구결과에서는 200 nm 이상 (16.7%), 150 – 200 nm ᅠ(18.2%), 100 – 150 nm (37.3%), 50 – 100 nm (27.8%) 범위에 해당하는 PS 나노 입자들이 3 분 처리 시, 200 nm 이상의 PS입자는 존재하지 않았으며, 15분처리 이후에는 50-150 nm 직경임을 확인하였다. 또한, PS의 골격의 방향족 페닐기의 고리 열림 현상과 PS 입자 표면의 물리적 변화를 나타냈다. 추가적으로 Scenedesmus obliquus 및 Human alveolar cell line A549에 대한 독성은 Scenedesmus obliquus는 초기 낮은 농도 (2 – 10 mg/L)에서는 독성이 점진적으로 증가하였으나 높은 농도 (30, 50, 100 mg/L)에서는 높은 독성의 결과를 보이고 세포의 성장을 방해에서는 큰 차이를 나타내지 않았다. A549 cells를 15 분 처리한 PS 나노입자의 농도가 100 mg/L 경우 개체수가 6.9% 로 감소한 결과를 나타냈다. 플라즈마를 이용한 미세플라스틱의 변화에 대한 공통점은 O를 함유하는 수산화기, 카복실기와 같은 기능기 생성으로 인한 CI index의 증가, O/C ratio의 증가, FTIR의 피크 변화, 유리전이온도 감소, 표면 거칠기 변화 및 평균 직경의 감소, 분해과정에서의 중간생성물 이는 활성 산소종과 미세플라스틱의 화학적 반응으로 인한 것이다[56- 58].
5. 결 론
플라스틱은 시간이 지날수록 물리적 화학적 풍화나 열과 압력 등 자연적인 풍화과정에 의해 분해되는데, 이 과정에서 생성된 5 mm 미만의 플라스틱 파편을 미세플라스틱이라고 정의하고 있다. 미세플라스틱은 인간의 체내에 흡수되면 독성을 유발하고, 여러 환경파괴를 야기하기 때문에 수년간 전세계적으로 주목받고 있는 환경오염 물질이다. 미세플라스틱은 다양한 환경에서 발견되며, 일부 연구에서는 미세플라스틱이 오염물질의 표면에 흡착되어 생물 체내에까지 축적된다는 연구도 보고된 바 있으나 그 처리방법이 제한적이라는 어려움을 겪고 있다. 고도산화 공정은 도시폐수 및 다양한 산업의 폐수처리를 위해 널리 연구되고 적용되고 있으며 미세플라스틱 제거에도 높은 효율성을 보이고 있다. 고도산화공정은 반응성이 높은 산화력을 이용하여 잘 제거되지 않는 난분해성 물질을 제거하기 위해 많이 사용되며 연구되는 기술이고, 다양한 오염물질에 무차별적으로 반응하여 반응속도가 빨라 효율적으로 오염물질을 분해한다는 특징이 있다. 이러한 특징들은 여러 환경에 다양한 형태로 존재하는 난분해성 유기오염물질을 제거하는 방법에 효율적으로 적용 가능하다. 또한 고도산화공정에서 생성된 활성산소종은 다양한 오염물질들을 분해할 수 있어 환경에 존재하는 미세플라스틱 제거가 가능하다고 여러 연구에서 알려졌다. 그러나 본 논문에서 조사된 미세플라스틱 분해 기술의 연구 결과에 따르면, 미세플라스틱을 완전히 제거하기 위해 알려진 고도산화공정의 수는 매우 적고 제한적이며, 대부분의 분해 반응이 미세플라스틱의 표면에 국한된 반응으로, 미세플라스틱을 이산화탄소, 물과 같은 최종산물로 완전히 분해할 수는 없었다. 따라서, 미세플라스틱을 넘어서 나노 단위의 미세플라스틱까지 환경에서 완전히 제거하기 위해서는 본 논문에서 조사된 고도산화공정들 이 외에 다양한 형태의 고도산화공정들도 앞으로 더 연구되어야 할 것이며, 이러한 연구들을 바탕으로 미세플라스틱 문제를 가까운 시일 내에 해결할 수 있는 새로운 기술이 개발될 필요성이 있다.
Acknowledgements
본 결과물은 환경부의 재원으로 한국환경산업기술원의 미세플라스틱 측정 및 위해성평가 기술개발사업의 지원(No. 2020003110005)과 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원 (No. 2021R1A2C1093183)을 받아 수행된 연구임.