흡착-열탈착 가스크로마토그래피 질량분석 방법을 이용한 숲속 대기 중 자연적 휘발성 유기화합물 분석에 관한연구
A Study on the Adsorption Capture-Thermal Desorption Gas Chromatography Mass Spectrometry Analysis of Biogenic Volatile Organic Compounds in Forests
Article information
Trans Abstract
Phytoncide, a forest healing indicator, is known to help suppress depression, anxiety, and stress of human. Furthermore, it has positive effects on blood pressures, pulses, and mood fluctuations. Previous studies mostly focused on phytoncide emission trends and its concentration prediction in forest. Moreover, a direct comparison of phytoncide concentrations between existing studies is often challenging owing to the use of differingunits, target analytes, analysis conditions, as well as unreported concentrations per type of the compound. Therefore, this study evaluated the overall performance of adsorption sampling and thermal desorption coupled with gas chromatography to evaluatethe phytoncide concentration in a forest atmosphere. To this end, the analysis quality management and analysis accuracy were evaluated for on-site samples in two different laboratories. The phytoncide analysis results obtained from each laboratory can serve as reference data for the adsorption capture-thermal desorption method applied to biogenic volatile organic compounds.
1. 서 론
빠르게 변화하고 있는 현대사회는 의학의 발전에 따라 수명이 늘어났고, 코로나19라는 신규 감염병의 유행이 더해져 건강증진, 여가활동에 대한 관심이 높아지고 있다. 2021년 통계청이 발행한 자료에 따르면 전국 13세 이상의 국민을 대상으로 한 조사에서 향후 늘려야 할 공공시설은 보건의료시설(24.2%), 공원·녹지·산책로(19.6%), 사회복지시설(14.7%) 순으로 조사되었으며 주말에 하고 싶은 활동으로는 휴식활동(70.7%)이 높은 비율로 조사되었다[1]. 또한 코로나 19 종식 이후 희망하는 국내여행에 대한 조사결과 자연 및 풍경감상(73.3%)이 가장 높은 비율을 차지하여 자연을 활용한 보건·복지, 건강증진에 대한 수요가 높아진 것으로 나타났다[2].
자연경관 감상 및 휴식 중 산림을 이용한 활동으로는 산림치유가 대표적인데 산림치유는 「산림문화·휴양에 관한 법률」에서 향기, 경관 등 자연의 다양한 요소를 활용하여 인체의 면역력을 높이고 건강을 증진시키는 활동이라고 정의하고 있다. 산림치유의 대표적인 자원인 피톤치드는 식물이 발산하는 자연적 휘발성 유기화합물(biogenic volatile organic compounds, BVOCs)을 말하며, 이소프렌(isoprene, C5H8), 테르펜(terpene, (C5H8)n)류 등의 화합물로 배출된다[3,4]. 피톤치드는 우울, 불안감, 스트레스 감소 효과를 보이며 혈압, 맥박, 그리고 감정의 변화에 긍정적인 영향을 준다고 알려져 있다[5].
피톤치드에 대한 발산 경향을 밝히기 위해 이전 연구에서 다양한 방법으로 연구를 진행해 왔다. Lee [6]는 α-pinene을 포함한 10종의 물질을 분석하고, 단위로는 pptv를 사용하여 충북지역 자연휴양림의 피톤치드 발생특성에 대해 연구했다. 산림분야의 논문으로 Kim [7]은 테르펜류 22종을 대상으로 분석하고, ng/m3의 단위를 사용하여 소나무림의 기상환경변화에 따른 피톤치드 농도예측 연구를 진행했으며, Jo [8]는 32종 물질을 대상으로 μg/m3의 단위를 사용하여 잣나무 임분 밀도에 따른 피톤치드 농도를 연구하였다. 최근 연구로 Lee [9]는 피톤치드 10종을 대상으로 표준상태(0oC, 1기압)로 환산한 ng/Sm3단위를 사용하여 피톤치드 농도예측을 위한 회귀분석 모델개발을 위한 연구를 진행하였다. 이처럼 피톤치드 발생경향, 농도예측에 대한 연구가 주로 진행되었으며 각 연구 마다 단위, 분석항목, 분석조건 등이 모두 다르고 물질 개별의 농도를 나타내지 않아 후속 연구에서 피톤치드 농도를 비교하는데 어려움이 있었다.
따라서 본 연구는 숲속 대기 중 피톤치드 농도 측정을 위해 현재 주로 이용되고 있는 흡착제를 이용 한 시료채취와 열탈착 가스크로마토그래피 질량분석법(thermal desorption-gas chromatography mass spectrometry, TD-GC/MS)을 이용하여 대기 환경 중 피톤치드분석 전반을 여러 측면에서 검증하고자 했다. 이를 위하여 실험실 내 분석 정도관리뿐만 아니라 서로 다른 두 실험실간의 분석 정확도를 실제 시료를 대상으로 각각 평가하였다. 이를 통해 이와 유사한 실험을 계획하거나 진행 중인 타 연구자들에게 피톤치드 분석에 대한 개별 실험실의 분석 결과를 제공하고자 한다.
2. 재료 및 방법
표준시료 및 현장 시료에 함유된 피톤치드에 대한 열탈착 가스크로마토그래피 질량분석을 수행하였다. 분석 조건이 다른 두 실험실(A, B)에서 분석의 정도관리를 위해 검출저한계, 검량선의 직선성, 재현성 평가를 각각 진행하였다. 실험실 간의 현장시료에 대한 재현성 평가를 위해 한 장소에서 중복으로 채취한 시료에 대해서 각 실험실에서 각각 분석하였다.
2.1. 피톤치드 표준물질 대상선정 및 전처리 방법
본 연구에서는 피톤치드의 주성분인 테르펜류는 치유의 숲 타당성 평가를 위하여 선정된 물질 중[8] 31종의 물질을 연구대상 물질로 선정하였으며 31종의 특성은 Table 1과 같다. 피톤치드 정성, 정량을 기본적인 정도관리를 위해 31가지 성분을 대상으로 표준시료를 준비하였고, 85%이상의 원액시료(Aldrich, USA)를 구매하여 메탄올을 용매로 단계적으로 희석하였다[10]. 단계적으로 희석하여 혼합한 혼합표준액 시료를 물질별 머무름 시간(retention time)을 확인하는데 사용하였다. α-pinene(C10H16), Camphene, β-pinene과 같은 분자량이 작고 비점이 낮은 순으로 검출되었고 Camphor(C10H16O)와 같은 카르보닐기가 있는 경우 비점이 높아져 머무름 시간이 늦어짐을 알 수 있다[11]. 본 연구에서 사용한 표준혼합용액에 대한 크로마토그램의 일례는 Fig. 1에 나타내었다.
본 연구에서 실험실 A에서는 액상시료를 기화시켜 흡착관에 흡착시키기 위해 기화장비(CT1100, CHEMTCKINS, korea)를 사용했다. 기화온도는 250oC로 설정하고 운반가스(질소)의 유량은 100cc/min으로 유지하여 주사기를 사용하여 1 μl의 액상 혼합 표준용액을 흡착관에 흘려주어 5분간 흡착되게 하였다. 실험실 B에서는 액상시료를 기 화시켜 200oC로 설정한 후 운반가스(질소)의 유량을 100 cc/min으로 유지하고 주사기를 사용하여 1oCμl의 액상 혼합 표준용액을 흘려주어 5분간 흡착되게 하였다. 각 실험실의 기화 온도는 200°C, 250°C, 300°C 중에서 재현성과 정밀도가 좋은 온도로 각각 설정하였다.
2.2. 피톤치드 현장 시료의 채취 방법
본 연구에서 피톤치드 분석을 타당성 평가를 위해 선정된 표준물질에 따라 31종류를 분석하였으며 피톤치드 채집용 매체는 Tenax TA를 충전한 스테인레스 스틸 흡착관(60/80 mesh, 1/4″ × 3.5″, KNR, Korea)을 사용하였으며 사용 전 310oC의 고온에서 2시간 동안 질소가스를 흘려주어 흡착관을 세척하였다[12]. 열탈착 가스크로마토그래피 질량 분석방법의 성능평가를 위한 실험에서 액체상 혹은 고체상 표준물질 적정량을 빈 흡착관에 주입하여 제작한 표준시료를 사용하였다. 이와는 별도로 실제 현장 시료에 대한 실험실간 재현성평가를 위해 잣나무숲에서 흡착관을 대기 흡인용펌프(MP-Σ30KNII, Sibata, Japan)에 연결하여 150 mL/min에서 1시간 포집하여 총 9L의 시료를 각각 5개씩 3월에 채취하였다(Fig. 2) [8]. 또한 시료채취 준비 시부터 시료분석 시까지 흡착관의 오염의 유 · 무를 확인하기 위해 현장바탕시료(field blank)를 각 실험실에서 3개씩 분석하였다[7].
2.3. 피톤치드 시료의 열탈착 및 GC 분석
표준시료 및 현장시료의 피톤치드 분석을 위해 자동 열탈착 장비가 연결된 가스크로마토그래피 질량분석기를 사용하였다. 두 실험실의 자동열탈착장비와 가스크로마토그래피 질량분석기는 서로 다른 장비와 분석조건으로 구성되었고, 상세한 내용은 Table 2와 같다. 열탈착기는 각각 TD-20(Shimadzu, Japan), TurboMatrix 350(PerkinElmer, USA)를 사용하였다. 열탈착기의 조건은 Tnenax-Ta가 충진된 극저온트랩으로 구성된 것을 사용하였으며, 흡착관에 흡착되어있는 물질은 열탈착기에 의해 각각 280°C, 300°C로 가열하여 30 ml/min, 40 ml/min으로 99.999%고순도 헬륨가스에 의해 열탈착기 내부로 운반된다. 이렇게 운반된 물질은 다시 –25°C이하에서 저온 농축되고, 농축된 물질들은 다시 300°C에서 열탈착 되어 가스크로마토그래피 컬럼으로 운반된다[13]. 가스크로마토 그래프와 질량분석계는 각각 GCMS-QP2020(Shimadzu, Japan), GCMS-QP2010 Plus(Shimadzu, Japan)로 구성된 것을 사용하였다. 기체크로마토그래프의 조건으로는 두 실험실 모두 60 m의 컬럼 장착하였고, 시료 분할비는 10 : 1, 오븐의 온도 또한 초기 50°C로 시작하여 120°C까지 분당 5°C씩 상승시키고, 210°C까지는 분당 3°C씩, 280°C까지는 분당 30°C씩 온도를 상승시킨 후 2분간 온도를 유지하는 조건으로 동일하였다. 질량분석계 또한 선택이온모드(selected ion monitoring, SIM)로 이온원(ion source)의 온도를 200°C로 분자이온을 검출하는 조건으로 사용하였다.
3. 결과 및 고찰
3.1. 피톤치드의 검량특성
열탈착 가스크로마토그래피 질량분석을 이용한 피톤치드 분석방법의 재현성을 각 표준물질의 체류시간과 피크 면적의 측면으로 구분하여 분석결과를 상대표준편차(relative standard deviation, 이하 RSD)를 평가 하였으며 그 결과는 Table 3에 요약하였다. r2 전체 31가지 물질 중 1개의 물질을 제외하고 모두 0.98이상의 값을 나타내었으며 분석의 정밀도를 상대표준편차(%, RSD)로 산출한 결과 2개 물질을 제외하고 10% 미만으로 나타났다. 직선성과 재현성이 기준 미만인 물질들은 본 연구에서는 검출되지 않아 실험에 영향을 주지 않은 것으로 판단된다 . 검출한계(lower detection limits, LDLs) 평가에 있어서 기기검출한계(instrumental detection limit, IDL)측면에서 검토 하였다. 기기검출한계는 통상적으로 가스크로마토그램상의 신호대 잡음비(signal to noise ratio)를 기준으로 추정되는데, 본 연구에서는 기기검출한계 추정을 위해 일반적인 방법인 신호대 잡음비 3배를 적용하였다[14]. 두 연구실의 기기 검출한계는 질량기준으로 볼 때 평균 0.71 ng 수준으로 나타났고, 25°C, 1기압에 9L를 적용하면 3.98 ppt (0.26 μg/m3) 수준으로 나타났다. 상세한 검량선의 결정계수(r2)와 상대표준편차(RSD), 기기검출한계는 Table 3과 같다.
3.2. 분석 기기의 회수율 평가
분석 결과의 정확성을 위해 열탈착기와 가스크로마토그래피 질량분석기 간의 회수율 평가를 수행하였다. 기화 장치를 이용하여 1 μl의 액상 혼합 표준용액을 흡착시킨 흡착관을 열탈착기-가스크로마토그래피 질량분석기로 분석하였고, 가스크로마토그래피에 직접 1 μl의 액상 혼합 표준용액을 주입하여 가스크로마토그래피 질량분석기로 분석하였다. 회수율 결과는 Table 4에 나타내었으며, 80~120% 이내로 양호한 것으로 확인되었다.
3.3. 현장시료에 대한 실험실간 측정 재현성 평가
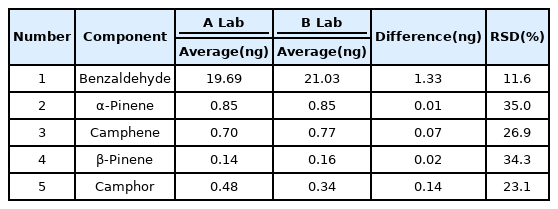
흡착제를 이용한 피톤치드 분석에 있어 분석과정 전반에 대한 총괄적인 정밀성 및 정확성을 평가하기 위해 실제상황을 대상에서 동일한 조건에서 중복적으로 채취된 시료간의 분석을 진행하였다. 본 연구에서 실제 현장시료에 대한 중복채취를 통하여 동시에 5개씩 채취된 시료로 분석대상물질의 측정결과에 대한 재현성과 정확성을 평가하였다. 동일한 유량으로 중복 채취된 시료에 대한 실험실 간 분석 결과 비교하기 위해 숲 환경에서의 실제 공기를 대상으로 총 5쌍의 시료를 채취하였다. 각각 5개의 시료를 A 실험실, B 실험실에서 각각 별도로 분석하였다. 시료 채취는 A 실험실에서 진행하였으며 분석은 두 실험실에서 독립적으로 이루어졌다. 시료의 오염도를 측정하기 위해 각각 3개의 현장바탕시료도 함께 분석하였다. 5개의 측정값은 이상치를 제외한 현장바탕시료의 평균값을 빼고 계산하였다. 측정 결과 31종의 물질 중 5종의 물질만(Benzaldehyde, α-pinene, Camphene, β-pinene, Camphor)이 검출되었으며 실제 시료의 측정재현성은 10~35% 수준으로 나타났다(Table 5). 선행연구에서 숲 속 대기 중 피톤치드는 α-pinene, β-pinene, Camphene, Camphor, Limonene, myrecene 등이 주요성분으로 나타났으며[10,11,13] Benzaldehyde의 경우 해당물질은 포함하여 분석한 연구가 있으나[8] 상세물질의 농도를 기재하기 않아 본 연구와 비교는 어려움이 있었다. 이는 숲속 대기 중의 피톤치드는 온도가 높을수록 식물에서 방출되는 양이 높다고 알려져 있는데[16,17] 본 연구에서는 온도가 비교적 낮은 3월에 포집하였기 때문에 5종의 물질만 검출된 것으로 보이며, Benzaldehyde(C7H6O)의 경우 인체에 유익하다고 알려져 있으나[18] 선행연구들에서는 테르펜류의 연구를 주로 진행하여 분석을 진행하지 않은 것으로 보인다.
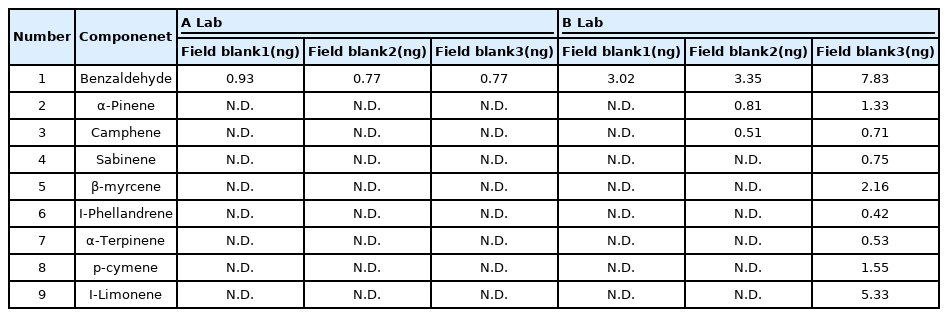
상대표준편차의 경우 시료의 농도가 낮을수록 크게 나타나는 경향이 있었는데 차이가 크게 나타난 것처럼 보이지만 실제 차이는 Benzaldehyde를 제외하고 0.2ng미만으로 나타났다(Table 4). 미국 EPA의 TO-17에서 권장하고 있는 흡착채취방법에 의한 VOC 측정방법의 성능평가 기준은 재현성 25% 이내로 제시하고 있지만[14] 피톤치드에 대한 시료는 농도가 낮아 25% 이상으로 나타난 것으로 보이므로 추후 추가적인 연구가 필요할 것으로 보인다. 시료의 오염도를 측정하기 위한 현장 바탕시료의 분석결과는 현장에서 바로 채취한 후 2일 이내에 분석한 A 실험실의 시료에서는 해당물질이 거의 검출되지 않았으나, 유리병에 밀봉하여 택배로 배송된 B 실험실의 시료에서는 해당물질이 일부 검출되었으며 현장바탕시료 3번에서는 다수의 물질이 검출되었다(Table 5).
4. 결론 및 향후 과제
본 연구에서는 산림분야에서 피톤치드 분석방법으로 주로 이용되고 있는 흡착제를 이용한 시료채취와 열탈착을 사용한 가스크로마토그래피 질량분석에 대하여 채취, 분석, 재현성, 검출한계 등의 측면에서 분석을 수행하였다. 31종의 피톤치드 물질을 다른 두 실험실에서 다른 장비, 다른 조건으로 분석한 결과 검량선의 직선성은 0.96 ~0.99 수준이였으며, 검출한계는 0.71 ng(3.98 pptv, 0.26 μg/m3) 수준이었으며, 분석 기기의 회수율 평가 결과는 80~120% 이내로 양호한 수준이었다. 분석방법 정도 관리 중 물질의 방법 검출한계평가에 대한 부분은 검토하지 못한 것이 한계점으로 평가 되며 추후 연구에서는 포함하여 연구의 정확성을 높이는 것이 필요하다. 31종의 물질 중 두 실험실 모두에서 5종(Benzaldehyde, α-Pinene, Camphene, β-pinene, Camphor)의 물질만이 검출되었으며, 농도 차이는 0.2 ng미만 RSD는 11.6% ~ 35.0%로 측정되었다. 두 실험실간의 분석조건이 다름에도 분석대상 물질 농도에 대한 큰 차이는 없었으며 추후 연구를 위해 물질별 농도, 분석방법, 단위를 상세히 기재하여 이후 연구자들이 물질을 비교할 수 있도록 하는 것이 필요하다. 또한 현장바탕시료 실험 결과 택배로 이송한 B 실험실의 현장바탕시료 3개 중 1개에서 다수의 물질이 높은 농도 값을 보였는데 이동과 보관 시에 흡착관 밀봉에 특별한 주의를 기울여야 하며 빠른 시간에 분석하고 동일 지점에서 3개 이상의 시료를 분석하여 신뢰성을 높이는 것이 필요하다.
본 연구는 피톤치드 분석을 다양한 관점에서 확인하고자 하였고, 이러한 분석기술을 실제 숲 환경 시료에 적용하였다. 또한, 두 실험실의 재현성 실험을 통해 숲 환경 내 피톤치드라 불리는 자연적 휘발성 유기화합물의 농도를 정량적으로 측정하고, 분석의 유효성을 확인하고자 하였다. 본 연구와 같이 숲 환경 내 피톤치드의 농도를 체계적으로 측정, 분석하고자 하는 연구에 중요한 정보를 제공할 수 있을 것으로 기대한다.
감사의 글
본 연구는 산림청(한국임업진흥원) 산림과학기술 연구개발사업'(2021382B10-2221-0101)'의 지원에 의하여 이루어진 것입니다.