퇴적물 중 다환방향족탄화수소의 실험실간 비교시험에 관한 연구
Interlaboratory Comparison Study on Polycyclic Aromatic Hydrocarbons in Sediment
Article information
Trans Abstract
The purpose of this study was to establish national standard method of polycyclic aromatic hydrocarbons (PAHs) in sediment. The samples were extracted using Soxhlet extraction or accelerated solvent extraction (ASE) and injected with benzo[e]pyrene-d12 as a surrogate internal standard. Napthalene-d8, acenaphthene-d10, phenanthrene-d10, chrysene-d12, Benzo(a)pyrene-d12, Indeno(1,2,3-c,d)pyrene-d12 were used as internal cleanup standards. P-terphenyl-d14 was injected as a recovery internal standard and analyzed using gas chromatograph-mass spectrometer (GC-MS). An interlaboratory comparison study was conducted, in which the three selected participating laboratories quantitatively analyzed several PAHs in certified sediment samples: IAEA-383, IAEA-417, IAEA-408, NIST-1944. Internal quality control was conducted individually. The results reported for PAHs by the three laboratories were acceptable, with a range of relative standard deviations (RSD) of 4.0-24.0% in IAEA-383(16.0 ng/g-290.0 ng/g). Results obtained for the IAEA-417 (150.0 ng/g-7,700.0 ng/g) and NIST-1944 samples (390.0 ng/g-9,700.0 ng/g) were also found acceptable with a range of RSD of 5.4-27.9% and 2.4-25.3%, respectively. Although the results of IAEA-408(3.3 ng/g-84.0 ng/g) were slightly higher than those of other RSDs, they were acceptable with a ranged of 2.5-38.7% at two of the laboratories. The limit of quantification of this method was found to be 0.003 mg/kg, and recovery rates ranged from 50.0% to 120.0%. The RSD was less than 25%, and the accuracy ranged from 60.0% to 135.0% in sediment.
1. 서 론
다환방향족탄화수소(Polycyclic aromatic hydrocarbons, PAHs)는 두 개 이상의 벤젠고리를 가지는 방향족 화합물로 독성이 많고, 일부는 발암물질로 알려져 있다[1]. 국제암연구소(International Agency for Research on Cancer, IARC)는 2006년 재평가를 통하여 benzo[a]pyrene을 Group 2A(인체발암 가능성물질)에서 Group 1(인체발암물질)로 상향 조정하였다[2]. 고리의 위치와 개수에 따라 벤젠고리가 2~4개인 물질은 기체상이나 고체에 흡착된 형태로, 5개 이상인 물질은 주로 고체에 흡착된 형태로 자연계에 존재한다[3]. 구성성분에 따라 200여 물질이 있지만, 미국 환경보호청(U.S.EPA) 등에서 관심을 가지는 16 항목의 PAHs를 우선 유해물질로 지정하고 있다[4]. 국내에서도 하천 · 호소 퇴적물 측정망이 시작된 2011년부터 퇴적물의 화학적 오염현황 평가가 부분적으로 시행되어왔으며 2012년부터 경년 변화를 평가할 수 있는 기반이 마련되었다[5]. 퇴적물은 수생 저서생물의 먹이와 서식처가 되는 주요한 환경매질이며 퇴적물의 PAHs에 대한 오염도는 생태독성, 퇴적물이 수질에 미치는 영향 등 종합적으로 평가해야 한다. 28개의 화학물질에 대한 담수 퇴적물에서의 평가지침에서는 PAHs, PCBs, 농약류 등이 포함되어있으며 크게 TEC(threshold effect concentration)과 PEC(probable effect concentration)로 평가하고 있다[6]. 퇴적물 중 PAHs의 모니터링은 퇴적물의 질을 평가하기 위한 중요한 항목이다. 따라서 PAHs와 같은 미량유기화학물질에 대한 분석효율과 체계화에 중점을 둔 표준화된 분석법을 정립하여 실험적 검증을 거친 수질오염공정시험기준의 마련이 필요하다. 실험실간 비교시험은 표준화하고자 하는 분석방법에 대한 진도(trueness)와 정밀도(precisions)를 검증하기 위해 실시하거나 표준분석방법에 대한 참여기관의 숙련도를 확인하기 위해 실시한다. 실험실간 비교는 둘 또는 그 이상의 실험실에서 미리 설정된 조건에 따라 같거나 유사한 표준물질 또는 인증표준물질에 대해 시험을 구성, 수행 및 평가하는 방법이다. 본 연구에서는 3개 기관을 대상으로 인증표준물질을 이용한 전처리 과정별 PAHs의 실험실간 교차분석 및 표준물질을 이용한 방법검출한계, 정량한계, 정확도, 정밀도를 분석한 결과를 토대로 수질오염공정시험기준 퇴적물 중 다환방향족탄화수소 측정방법으로의 적용 가능성을 검토하고자 하였다.
2. 재료 및 방법
2.1. 시약 및 기구
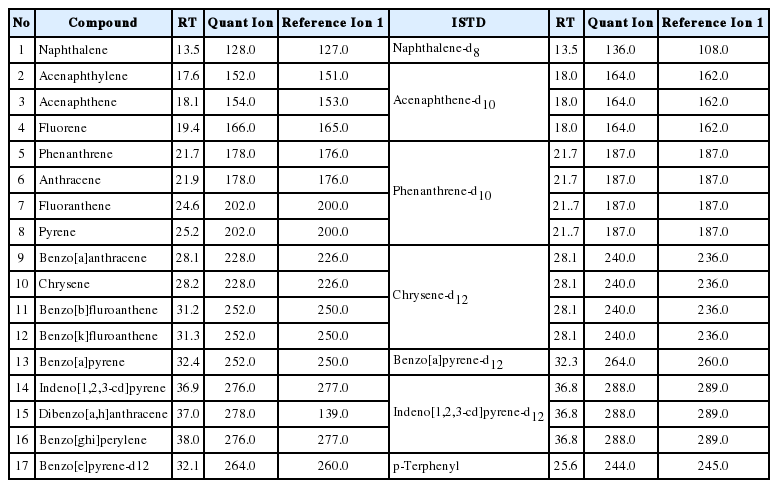
분석대상 PAHs 16 항목 (PAH mixture)과 실린지 첨가용 내부표준물질, 시료추출용 대체표준물질, 정제용 내부표준물질을 Accustandard(USA)와 Chiron(Norway)에서 각각 구입하여 사용하였다. 실린지첨가용 내부표준물질로 p-terphenyl-d14,(Accstandard 社), 시료추출용 대체표준물질로 Benzo[e]pyrene-d12,(Chiron 社)를, 정제용 내부표준물질로 napthalene-d8, acenaphthene-d10, phenanthrene-d10, chrysene-d12(Accustandard 社)와 benzo[a]pyrene-d12, indeno[1,2,3-cd]pyrene-d12 (Chiron 社)를 분석항목의 성질에 따라 다르게 사용하였다. 수분제거를 위한 무수황산나트륨은 Wako(Japan)의 특급시약을, 정제를 위한 컬럼으로 플로리실과 실리카겔은 Merk 社(Germany) 제품으로 사용하기 전에 각각 200.0oC와 130.0oC에서 약 18시간 건조시켜 활성화 한 것을 사용하였으며, 유기용매(acetone, hexane, dichloromethane, diethyl ether, pentane)는 J.T. Baker(USA)의 잔류농약 분석용을 사용하였다.
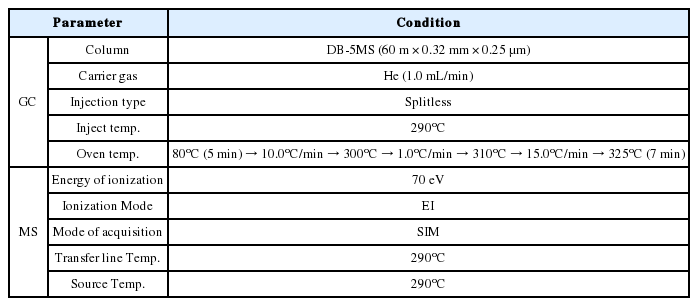
퇴적물 시료를 추출하기 위해 가속용매추출 장치(ASE, DIONEX ASE 350, USA.)와 PAHs 분석을 위해 가스크로마토그래프-질량분석기(Agilent 7890D/7000A MSD, USA., Bruker CP-3800/320-MS, USA.)를 각각 사용하였다.
2.2. 전처리 및 분석방법
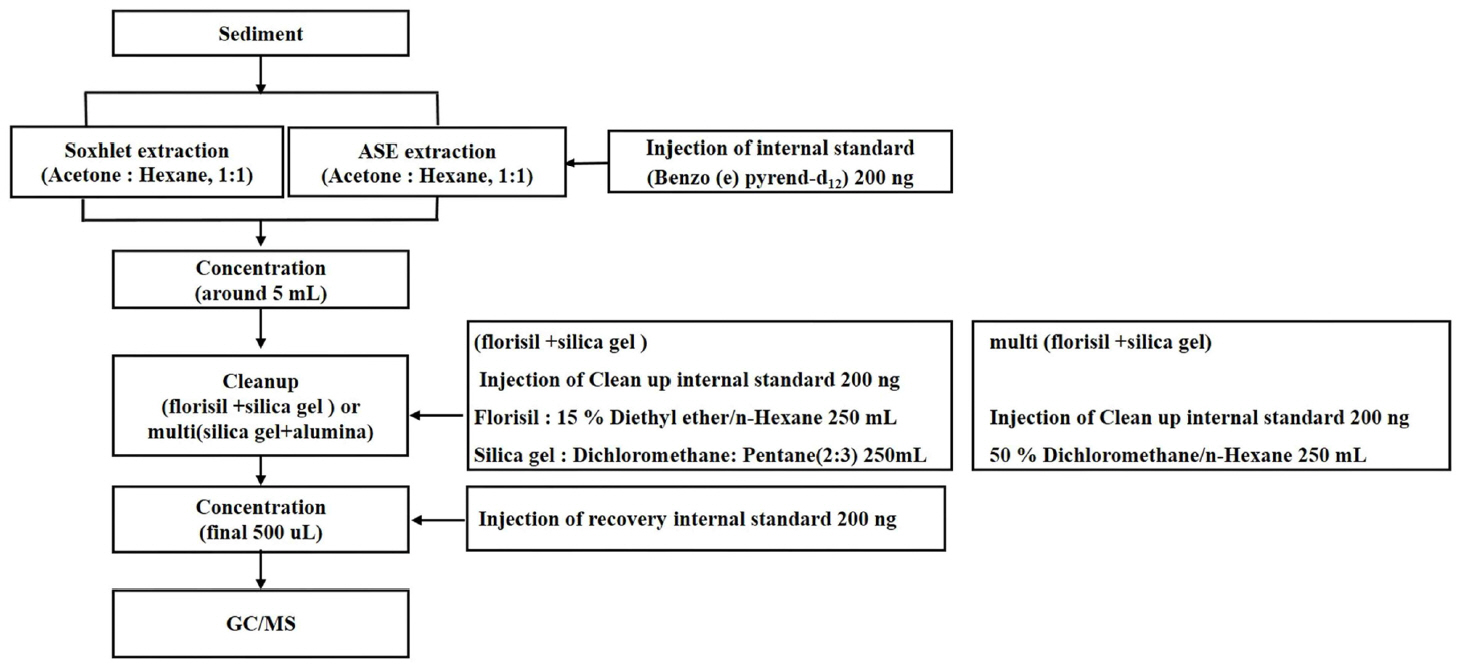
추출방법으로 속슬렛 추출장치와 시간과 용매의 사용이 경제적인 가속용매추출장치를 사용하였다. Sea sand (10~20 mesh, 대정)에 16 항목의 PAHs를 첨가한 내부정도관리 시료는 속슬렛 장치를, 인증표준물질(CRM) 시료는 가속용매추출장치로 전처리 하였다. 내부정도관리 시료는 10 g, 인증표준물질(CRM) IAEA-383은 5.0 g, IAEA-417은 1.0 g, IAEA-408은 10.0 g, NIST-1944는 1.0 g을 시료량으로 하여 벤조[e]피렌-d12를 10.0 mg/Lᅠ제조하여 각각의 시료에 20.0 μL를 첨가(200.0 ng) 후 아세톤과 헥산 혼합용매(1 : 1)로 추출하였다. 가속용매추출 조건은 Table 1과 같다.
추출한 시료는 약 5 mL까지 농축하여 정제용 내부표준물질을 첨가 후 플로리실과 실리카겔을 이용하여 정제하였다. 플로리실 컬럼 정제는 15.0% 디에틸에테르/노말헥산 250.0 mL로 용출하여 농축 후 실리카겔 정제용 시료로 하였으며, 이를 실리카겔 컬럼으로 디클로로메탄과 펜탄 혼합용매(2 : 3) 250.0 mL를 유출하여 정제하였다. 실리카겔/플로리실 다층컬럼 정제 시에는 플로리실, 실리카겔, 무수황산나트륨을 순차적으로 컬럼에 충전하여 디클로로메탄:노말헥산(1:1)을 250.0 mL 사용하여 정제하였다(Fig. 1, 2). 용출액은 0.5 mL까지 농축하여 실린지첨가용 내부표준물질인 P-터페닐-d14를 200.0 ng 첨가한 뒤 GC-MS로 분석하였다(Table 2, 3).
방법바탕시료도 동일한 방법으로 전처리·추출하였으며, 시료의 전처리과정 및 정제컬럼을 Fig. 1과 Fig. 2에 도식화하여 나타내었다.
2.3. 내부 정도관리 및 인증표준물질 분석
방법검출한계와 정량한계를 측정하기 위하여 3개의 각 기관별로 7개의 Sea sand 시료에 16 항목의 PAHs를 각각 첨가하여 전처리 후 GC-MS로 분석하였다. 또한 정확도와 정밀도를 확인하기 위하여 5.0 ng/g과 20.0 ng/g을 각각 4개 시료에 첨가하고, 전처리 후 GC-MS로 분석하였다.
분석방법에 대한 검증을 위하여 4개의 인증표준물질에 시료추출용 대체표준물질(surrogate)인 벤조[e]피렌-d12를 200.0 ng 첨가한 뒤 ASE로 추출하여 3개의 기관에 배포 후 같은 내부표준물질을 사용하여 정제 농축 후 같은 조건의 GC-MS로 분석하였다.
3. 결과 및 고찰
3.1. 전처리 과정에서의 회수율 비교
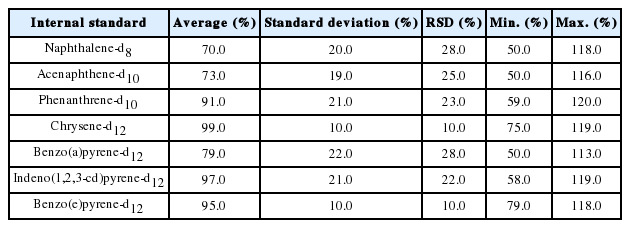
퇴적물 중 16 항목의 PAHs에 대한 3개 기관의 내부정도관리 및 인증표준물질들에 대한 시료추출용 대체표준물질(surrogate)인 벤조[e]피렌-d12의 회수율은 평균 95.0%, (79.0~118.0)%의 범위와 상대표준편차 10.0%를 나타났다.
6종의 정제용 내부표준물질의 회수율의 범위와 상대표준편차는 각각 나프탈렌-d8 평균 70.0%, (50.0~118.0)%와 28.0%, 아세나프텐-d10 평균 73.0%, (50.0~ 116.0)%와 25.0%, 페난트렌-d10 평균 91.0% (59.0~120.0)%와 23.0%, 크라이센-d12 평균 99.0% (75.0~119.0)%와 10.0%, 벤조[a]피렌-d12 평균 79.0%, (50.0~113.0)%와 28.0%, 인데노[1,2,3-c,d]피렌-d12은 평균 97.0%, (58.0~ 119.0)% 와 10.0%를 나타내었다(Table 4).
3.2. 내부정도관리 분석 결과
3.2.1 방법검출한계 및 정량한계
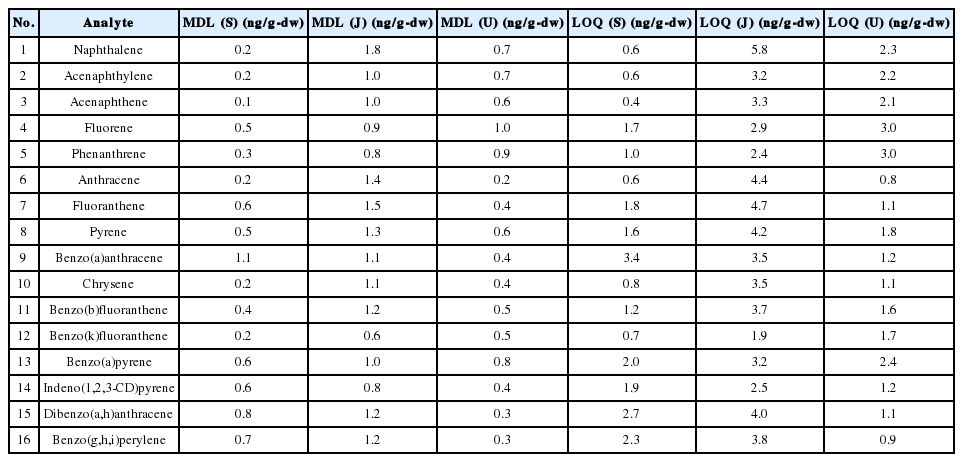
3개의 기관에서 각각 방법검출한계, 정량한계 실험 결과를 Table 5에 나타내었다. 기관별로 동일하게 Sea sand g 당 3.0 ng을 첨가하여 방법검출한계와 정량한계를 측정하였다. 3개 기관에서 측정한 방법검출한계는 16개 PAHs에 대하여 평균 0.5~0.9 ng/g-dw를 나타내었고, 정량한계는 평균 1.4~2.9 ng/g-dw의 범위로 나타났다. 16 항목 PAHs에 대한 정량한계는 3개 기관 평균 2.7~3.0 ng/g-dw로 나타났다. 2개 기관은 0.4~3.4 ng/g-dwᅠ범위를 나타내었으나 1개 기관은 각각의 항목에 대해서 1.9~5.8 ng/g-dw의 농도 범위로 나타나 다른 기관보다 높게 났다. 이는 저농도 3.0 ng/g-dw에서 속슬레 추출 및 컬럼 정제 시의 오차에 의한 것으로 판단된다.
3.2.2 정확도 및 정밀도
정확도와 정밀도는 2개의 다른 농도에서 각각 4개의 시료를 분석하였으며 3개 기관에서 분석한 결과를 Table 6에 비교하였다.
16 항목의 PAHs 5.0 ng/g-dw를 4개시료에 첨가한 뒤 분석한 결과 16 항목에 대하여 3개기관에서의 정확도는 64.9~118.8%로 나타났고, 기관 간 상대표준편차는 0.8~26.8%로 나타났다. 16 항목 PAHs에 대한 3개기관의 정밀도 간의 표준편차는 0.3~23.6%로 나타났다.
16 항목의 PAHs 20 ng/g-dw를 4개 sea sand 시료에 첨가한 뒤 분석한 결과 16 항목에 대하여 3개기관에서의 정확도는 72.0~128.5%로 나타났고, 기관 간 상대표준편차는 4.7~20.7%로 나타났다. 16 항목 PAHs에 대한 3개기관의 정밀도 간의 표준편차는 0.8~13.1%로 나타났다. 다른 매질에 비하여 분석이 까다로운 퇴적물 시료 분석 결과의 기관 간 상대표준편차가 30.0% 이내로 표준 시험방법으로 적당한 것으로 나타났다.
3.3. 인증표준물질(CRM) 분석 결과
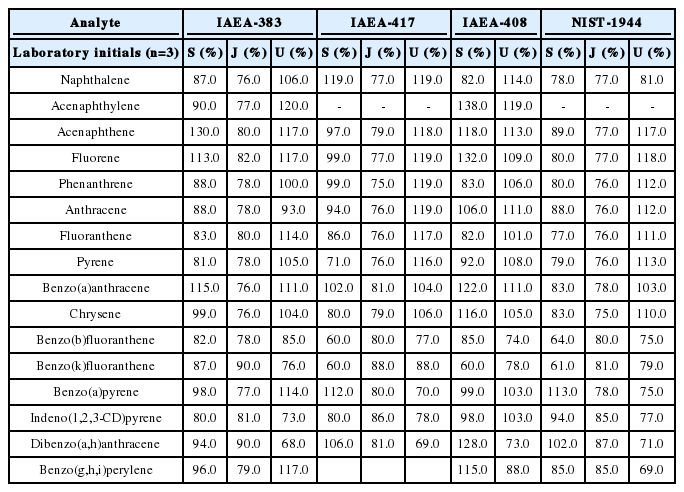
4가지의 CRM (IAEA-383, IAEA-417, IAEA-408, NIST-1944)에 대하여 3개기관에서 분석한 정확도 결과를 Table 7에 나타내었다. IAEA-408 중 저농도 3.6 ng/g 의 Acenaphthylene이 1개 기관에서 5.0 ng/g으로 138% 의 정확도를 나타내어 인증범위 2.1 ng/g~4.7 ng/g를 초과하여 나타내었으나 나머지 모든 물질들에 대해서는 60.0~132.0%의 범위로 모두 인증범위 내에서 분석되었다. IAEA-383 16.0 ng/g~290.0 ng/g에 대한 3개 기관 간 상대표준편차는 4.0~24.0%, IAEA-417 150.0 ng/g~7,700.0 ng/g, NIST-1944 390.0 ng/g~9,700.0 ng/g는 3개 기관 간 상대표준편차가 각각 5.4~27.9%, 2.4~25.3%로 비슷하게 나타났다.
3.4. 정도관리 목표값 설정
3개기관을 대상으로 16 항목 PAHs에 대한 내부정도관리 및 CRM 분석결과를 통하여 정량한계는 16 항목 PAHs 각각에 대하여 3.0 ng/g, 회수율은 50.0~120.0%, 정확도는 65.0~135.0%, 정밀도는 25.0% 이하로 인증범위 2.1 ng/g~4.7 ng/g에 준하여 제안하였다.
4. 결 론
퇴적물 중 16 항목의 다환방향족탄화수소(PAHs)에 대한 3개 기관의 내부정도관리 및 인증표준물질들에 대한 시료추출용 내부표준물질의 회수율은 평균 95.0%, 79.0~118.0% 범위이며 상대표준편차는 10.0%로 나타났다. 정제용 내부표준물질(cleanup internal standard) 6개 항목에 대한 회수율은 평균 85%, 70.0~99.0% 범위이며 상대표준편차는 28% 이내로 나타났다.
3개 기관에서 측정한 방법검출한계는 16 항목 PAHs에 대하여 평균 0.5~0.9 ng/g-dw를 나타내었고, 정량한계는 평균 1.4~2.9 ng/g-dw의 범위로 나타났다.
16 항목의 PAHs 5.0 ng/g-dw를 4개시료에 첨가한 뒤 분석한 결과 16항목에 대하여 3개기관에서의 정확도는 64.9~118.8%로 나타났고, 기관 간 상대표준편차는 0.8~26.8%로 나타났다. 16 항목 PAHs에 대한 3개기관의 정밀도 간 상대표준편차는 0.3~23.6%로 나타났다.
16 항목의 PAHs 20.0 ng/g-dw를 4개시료에 첨가한 뒤 분석한 결과 16 항목에 대하여 3개기관에서의 정확도는 72.0~128.5%로 나타났고, 기관간 상대표준편차는 4.7~20.7%로 나타났다. 16 항목 PAHs에 대한 3개기관의 정밀도 간의 상대표준편차는 0.8~13.1%로 나타났다.
기존 퇴적물측정망 운영계획에 따라 분석했던 측정망 매뉴얼[3]의 정도관리 목표값과 3개기관을 대상으로 16 항목 PAHs에 대한 내부정도관리 및 CRM 분석결과를 함께 검토한 결과 정량한계는 16 항목 PAHs 각각에 대하여 3.0 ng/g의 목표값을 두는 것으로 결정하였다. 회수율은 50.0~120.0%, 정확도는 65.0~135.0%, 정밀도는 25.0% 이하로 인증범위 2.1 ng/g~4.7 ng/g에 준하여 제안하였다.
Acknowledgements
이 연구는 국립환경과학원 수질오염공정시험기준 제정을 위한 사업 및 미규제수질유해물질 적정처리방안 연구(NIER-2019-01-01-037)사업의 일환으로 수행되었습니다.