On-line SPE-LC-Orbitrap 질량분석기를 활용한 잔류농약 다성분 신속동시 분석방법연구
Simultaneous and Rapid Analysis of Multi-pesticide Residues using On-line SPE-LC-Orbitrap Mass Spectrometry
Article information
Trans Abstract
In this study, we developed a rapid and simple analytical method for the simultaneous determination of pesticide residue in environmental water using an LC-Orbitrap (Q-Exactive Plus) with electrospray ionization mode. The detection process was performed in Full scan/ddMS2 mode. Sample preparation was performed using online SPE. Only 1 mL of each water sample was injected during the on-line SPE and the samples were concentrated in a Hypersil GOLD aQ trapping column. We compared seven gradient programs and three analytical columns to analyze the 360 pesticides. Most compounds were detected using the CORTECS C18 column with the 7th gradient program method. The established method was validated by linearities, accuracy, precisions, and limits of quantification (LOQ) of the 340 pesticides. The calibration linearities were over 0.994 and LOQ were 5.2-283.3 ng/L. Accuracy and precision values were achieved in the ranges of 91-120% and 0.63-8.21%, respectively. This method can be applied to effectively monitor the health of aquatic environments and can be potentially applicable in a variety of fields in the future.
1. 서 론
농약은 병해충 및 잡초방제, 생산량 증대, 품질과 저장성의 향상 등을 위한 농업에 있어 중요한 화학물질이다[1]. 살포된 농약은 환경중에 잔류하면서 시간경과에 따라 분해되어야 하지만 몇몇 농약들은 물리화학적 특성에 기인하여 농작물이나 환경 중에 오랜 기간 잔류하며 먹이사슬을 통하여 인체에 축척 되기 때문에 농약은 오랜 기간 동안 전세계적으로 관리와 관심의 대상이 되고 있다[2,3]. 현재 국내에서는 각 부처(농림축산식품부, 식품의약품안전처, 농촌진흥청, 산림청, 환경부)에서 농약을 관리하고 있으며 농림축산식품부, 식품의약품안전처, 농촌진흥청 및 산림청에서는 농산물별로 국내 · 외 등록된 498종 농약에 대해서 잔류허용기준(Maximum Residue Limits, MRL)을 설정하여 관리하고 그 외 잔류허용기준이 없는 농약들은 일률적으로 0.01 ppm의 기준을 적용하는 농약 허용물질목록관리제도(Positive List System, PLS)를 2019년 1월 1일부터 전면 시행하고 있다[8]. 추가적으로 498개의 농약에 대하여 식품 공전 잔류농약 분석법 실무 해설서를 만들어 식품 중 잔류농약 수준을 검사 및 평가를 위하여 다성분 및 단성분 분석법을 제공하고 있다[4,5]. 한편, 환경부에서는 수질 및 수생태계 보전에 관한 법(법률 제 14490호), 물환경보전법(법률 제 14532호), 토양환경보전법(법률 제 15102호) 및 잔류성유기오염물질 관리법(법률 제 8292호)등을 바탕으로 수질과 토양 오염의 방지를 위하여 유기인계 및 유기염소계 화합물을 대상으로 농약잔류 허용기준을 관리하고 있으며 공정시험기준 사용을 의무화하여 운영하고 있다[6]. 먹는물, 지하수, 수질오염공정시험기준은 유기인계(이피엔, 파라티온, 디메톤, 다이아지논, 펜토에이트)의 정량한계를 500 ng/L로 제안하였다. 토양오염공정시험기준에서는 0.05 mg/kg을 정량한계로 삼고 있다. 잔류성오염물질 공정시험기준에서는 스톡홀름협약 이행일환으로 환경대기, 하천수/호소수, 폐수, 토양/퇴적물 시료에서 유기염소계 농약류(알드린, 디알드린, 디디티 등 이성질체 포함 25종)의 방법검출한계를 5.0~20 ng/L범위를 잡고있다. 농약류의 전처리 과정은 매질에 따라 속슬레 추출(soxhlet extraction), 액-액 추출(liquid-liquid extraction), 초음파 추출장치(ultrasoundsonication extraction), 고체상 추출(solid phase extraction, SPE), QuEChERS법(Quick, Easy, Cheap, Effective, Rugged, and Safe) 및 온라인 고체상 추출법(on-line solid phase extraction, on-line SPE)이 있으며 식품공전에서는 온라인 고체상 추출법을 제외한 위의 과정들로 처리하고 있으며, 환경부의 공정시험 방법에서는 QuEChERS법과 온라인 고체상 추출법을 제외한 다양한 전처리법으로 진행되고 있다[7]. 전처리 이후에는 분석물질의 특성에 따라 ECD (electron capture detector), NPD (nitrogen phosphorous detector), FPD (flame photometric detector), UVD (UV photometric detector) 및 MS/MS (tandem mass spectrometer) 등을 연계하여 GC (gas chromatography)와 LC(liquid chromatography)로 분석된다[6]. 최근 분석기술의 발달로 1995년 quadrupole-time-of-flight(TOF) 질량분석기, 2005년에 Fourier transform orbitrap 질량분석기가 상용화 되었고, 이들의 높은 질량분해능과 질량정확도는 수백종의 복잡하고 다양한 농도범위의 혼합물 동시분석을 가능하게 하였다[18,10,11]. 특히, Orbitrap은 50,000이상의 분해능(resolution)과 5 ppm 이하의 높은 질량정확도를 가지고, 분석물질의 질량값이 바탕값과 확연히 구분되 매질의 영향을 최소화 할 수 있기 때문에 다양한 매질에서 수백종의 유기물질을 분석하는 연구에 사용되고 있다[9,12-14].
이에 본 연구는 수질환경 기준 및 먹는물 수질기준에 포함되지 않지만, 국민의 건강에 위협이 될 수 있는 잔류허용기준으로 관리되고 있는 498종 중 LC분석에 적합한 360종의 농약류(제초제, 살균제, 살충제 등)를 선정하여 분석에 중점을 두고, 수질시료에 적합한 온라인 고체상 추출장비와 다성분 분석에 적합한 LC-Orbitrap 질량분석기를 활용하여 다성분 동시분석 및 적용성을 평가하였다.
2. 재료 및 방법
2.1. 시약 및 표준물질 제조
농약류(제초제, 살균제, 살충제 등) 360종의 표준물질은 Accustandard (New Haven, CT, USA)에서 구입하였고, 포름산 암모늄(ammonium formate)은 Sigma-Aldrich (St. Louis, MO, USA)에서 메탄올(methanol), 아세톤(acetone), 아세토나이트릴(acetonitrile)는 Honeywell (Muskegon, USA)에서 모두 HPLC급을 사용하였다. 분석검증에 바탕시료로 사용한 정제수(water)와 포름산(formic acide)은 Fisher scientific (Hampton, USA)에서 구매하였다. 10 mL 볼륨플라스크에 360종의 표준용액을 각각 10 μL씩 넣은 후 눈금선까지 아세토나이트릴을 채워 1 mg/L의 혼합표준용액를 만들었다.
2.2. 고분해능질량분석기 기기조건 및 데이터 처리
분석에 사용한 고분해능 질량분석기는 Orbitrap Q Exactive Plus (Thermo Fisher Scientific, San Jose, CA, USA)모델을 사용하였다. 질량분해능(mass resolution)은 70,000으로 설정하였고, 질량정확도(mass accuracy)는 5 ppm이하 조건으로 설정하고, 100~1000 m/z 질량범위에서 full scan/ddMS2 (full scan data dependaent MS/MS) 분석모드로 양이온과 음이온을 동시 측정하였다. Oribitrap 질량분석기조건에 대한 상세한 조건은 Table 2에 나타내었다. 측정된 데이터는 accurate mass 기기프로그램인 Thermo Scientific 사(USA)의 TraceFinder 4.1을 통해 처리 되었다.
2.3. On-line SPE 전처리 조건 및 LC조건
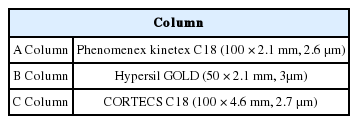
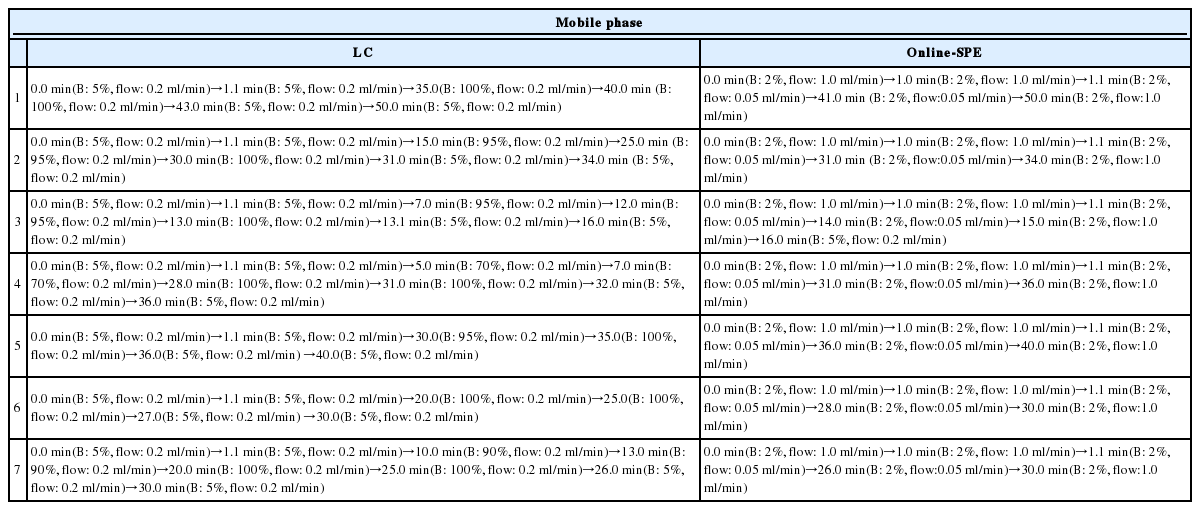
On-line SPE는 EQuan MAX online (Thermo Fisher Scientific, San Jose, CA, USA)장비와 함께 Hypersil GOLD aQ (20 × 2.1 mm, 3 μm) (Thermo Scientific, San Jose, CA, USA)를 농축컬럼으로 사용 하였다. 수환경 중 오염물질의 농도가 낮은 점을 고려하여 시료주입량은 1 mL로 설정하여 1000배 농축시켰으며 정제용 용매로 2% 메탄올을 사용하였다. 온라인 고체상 추출장치를 통해 전처리가 완료된 시료는 LC로 보내져 분리되었으며 사용된 LC는 Dionex Ultimate 3000-Q (Thermo Fisher Scientific, San Jose, CA, USA)이다. 이온화는 ESI(positive 및 negative mode) 방식으로 하였고, 이온화소스 온도 및 capillary 온도는 각각 300°C, 320°C로 설정하였으며, spray voltage는 3,800 V로 하였다. 분리능 비교 위하여 3가지 분리컬럼(Kinetex C18, Hypersil GOLD, CORTECS C18)과 9가지 이동 상 조건을 비교하였다(Table 3, Table 4). 컬럼 오븐의 온도는 40°C로 고정하였다. 이동상은 모두 동일하게 정제수(0.1% 포름산, 5 mM 포름산 암모늄)와 메탄올(0.1% 포름산, 5 mM 포름산 암모늄)를 이용하여 200 μL/min 유속으로 시간에 따라 비율을 변화시켜 사용하였다.
2.4. 분석법 유효성 검토
본 연구에 사용된 전처리(온라인 고체상 추출법) 및 기기분석방법 검증을 위하여 앞서 제조한 혼합표준용액를 순차적으로 희석한 후 정제수에 100배 희석하여 검정곡선 7포인트(0.01, 0.02, 0.05, 0.1, 0.2, 0.5, 1 μg/L) 10 mL를 제조하였고 직선성(linearity)을 확인하였다. 방법검출한계(method detection limit, MDL) 및 정량한계(limit of quantification, LOQ)는 5 μg/L 혼합시료를 정제수에 100배 희석하여 0.05 μg/L 7개 시료 조제 후 검출된 농도의 표준편차에 3.14 및 10을 곱하여 산출하였다. 정확도는 혼합시료 20 μg/L를 정제수에 100배 희석하여 0.2 μg/L로 제조 후 5회 반복 측정값의 평균값과 원농도의 비율에 100을 곱하여 산출하였으며, 정밀도는 5반복된 농도의 표준편차와 평균값의 비율에 100을 곱하여 산출하였다.
3. 결과 및 고찰
3.1. 기기분석조건 최적화
국내외에서 사용하는 농약360종의 분석조건설정을 위하여 개별 표준물질을 제조하였다. Table 2 조건으로 처리하고 분석물질들의 정보(질량값(exact mass), 동위원소 패턴(isotope pattern), 조각화 패턴(fragment pattern), 머무름 시간(retention time)를 입력 하였다. 예를 들어 azoxystrobin의 2 μg/L표준용액 100 μL를 주입하여 ESI로 이온화 시키고, 질량값 100~1000 amu범위에서 full scan을 하면 azoxystrobin의 크로마토그램(Fig. 1(a))과 MS 스펙트럼(Fig. 1(b))을 얻을 수 있다. Azoxystrobin의 분자식은 C22H17N3O5이며 exact mass값은 403.1130 amu이다. 관찰된 질량 스펙트럼에서 404.1241 amu가 나왔으며 이는 azoxystrobin이 [M+H]로 이온화 되었다는 것을 보여준다(Fig. 1(b)). 또한 이온화 스펙트럼에서 탄소동위원소 패턴이 규칙적으로 나타났으며(Fig. 1(c)), 라이브러리의 시뮬레이션과 높은 유사성을 가졌다. 조각화 패턴도 라이브러리 시뮬레이션과 같은 유사성을 나타냈다(Fig. 1(d)). 측정된 azoxystrobin의 질량정확도는 −2.08 ppm으로 나왔으며, 유럽 가이드라인(high resolution/high mass accuracy로 농약 분석시 성분확인의 기준으로 설정)이 지정한 5 ppm이내의 질량정확도를 만족하여 정성기준에 충족되었다고 판단하였고, 실제 고분해능질량분석기로 분석하는 다이옥신류 정도관리 기준으로 질량정확도를 5 ppm을 적용하고 있어 full scan데이터의 신뢰도를 제공한다[15]. 따라서 농약 360항목에 대해서 검출감도가 낮거나 불검출 된 abamectin B1a, chloranocryl, bifenox 등 12항목을 제외하고 348항목에서 질량정확도가 −4.19~4.61 ppm범위였으며, 이 결과는 348항목이 정성기준에 충족된 것으로 판단된다(Table 1, Fig. 2) [9].
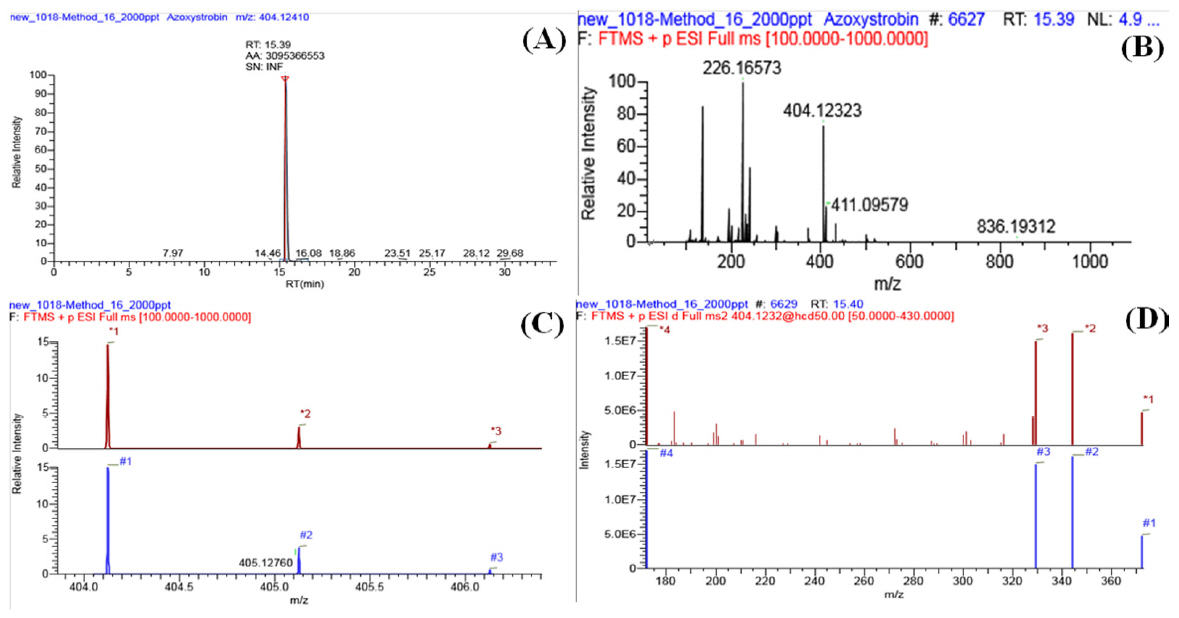
Azoxystrobin standard (A) chromatogram (B) mass spectrum (C) isotope pattern (D) fragment pattern of azoxystrobin.
3.2. On-line SPE 및 LC 조건 최적화
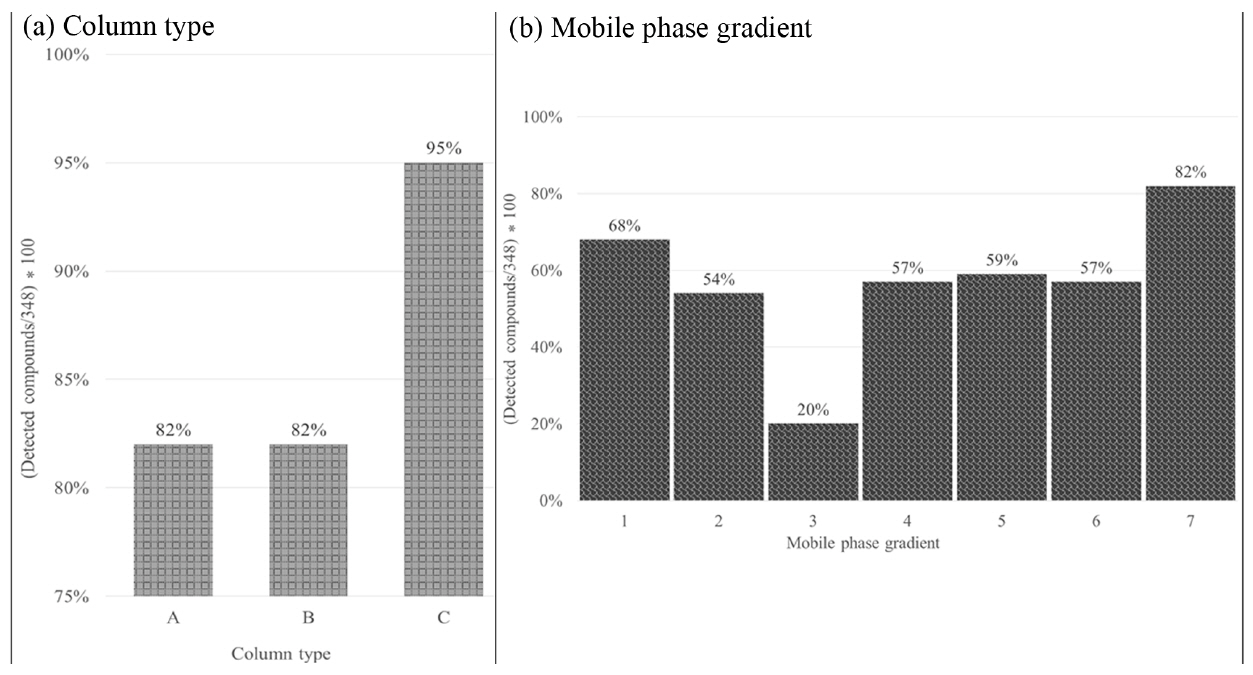
On-line SPE은 기존 고체상 추출법에서 행했던 시료 추출 및 농축 과정을 장비를 이용하여 자동화한 시스템이다[16,17]. On-line SPE에 시료를 주입하면 농축컬럼(SPE카트리지)에 농축되고 LC이동상을 이용하여 농축된 물질을 탈착시킨 후 이를 LC의 분리용 컬럼으로 보내는 원리로 작동된다[19]. 분리능이 높아도 성분들의 수가 많아지면 머무름 시간이 겹칠 수 있고, 이러한 경우 조각화가 되지 않아 데이터를 얻기 어렵다. 이에 물질 분리(chemical separation)가 필요하며 물질 분리에 영향을 주는 이동상 조건(gradient program)과 분리컬럼(Table 4, Table 3)을 변화시켜 비교하였다. 이동상 유속조건에서 분석시간은 짧게는 16분부터 길게는 50분까지 소요되었고, 이동상의 조건에 따라 최소 68항목부터 최대 285항목까지 검출되었다(Table 4, Fig. 3(B)). 16분은 분석시간이 짧아 성분간의 분리에 한계가 있었고, 50분은 많은 시간이 소요되었지만 성분간의 분리는 잘 이루어 졌다. 하지만 많은 시간이 소요되기 때문에 용매비율을 조절하여 비교적 적절한 시간에 많은 항목을 검출할 수 있는 이동상 조건(36분)을 최적화하였다. 이 조건을 바탕으로 다성분 농약분석에 일반적으로 사용되는 C18 컬럼들(A, B, C)을 비교하였고 각각 285, 287, 340항목이 검출되었다. 이러한 결과는 같은 충진제라도 컬럼의 길이, 단면의 넓이, 제조사에 따른 충진제 모양 및 특이성 등에 따라 물질간의 분리를 다르게 일어나게 하여, 검출개수로 나타난 것이라 생각된다(Table 3, Fig. 3(A)).
3.3. 유효성 검증
본 연구에서 확립한 온라인 고체상 추출방법 및 분석시스템의 대한 유효성 검증 위하여 농약 340종을 대상으로 검정곡선의 직선성, 정확도, 정밀도, 검출한계 및 정량한계 등의 정도관리를 실시하였다. 각 성분별로 질량 스펙트럼을 관찰하여 정량이온과 확인이온을 선정하였으며 대부분 [M+H] [M-H] 등의 형태로 검출되었다. 상관계수(r2)는 0.994이상으로 각 농도 범위에서 양호한 직선성을 나타내었다. 방법검출한계와 정량한계는 각각 1.64~88.95 ng/L, 5.23~283.29 ng/L으로 수질오염, 먹는물공정시험기준의 유기인계 농약류(이피엔, 파라티온, 디메톤, 다이 아지논, 펜토에이트)들의 정량한계가 500 ng/L수준임을 고려하면 본 연구에서의 정량한계는 수질중의 농약류의 모니터링에 충분히 적용 가능할 것으로 판단된다. 정확도는 91~120%으로 75~120%를 만족하였으며, 정밀도는 0.63~8.21%로 25%이하를 만족하여 모두 양호한 결과가 도출되었다(Fig. 4).
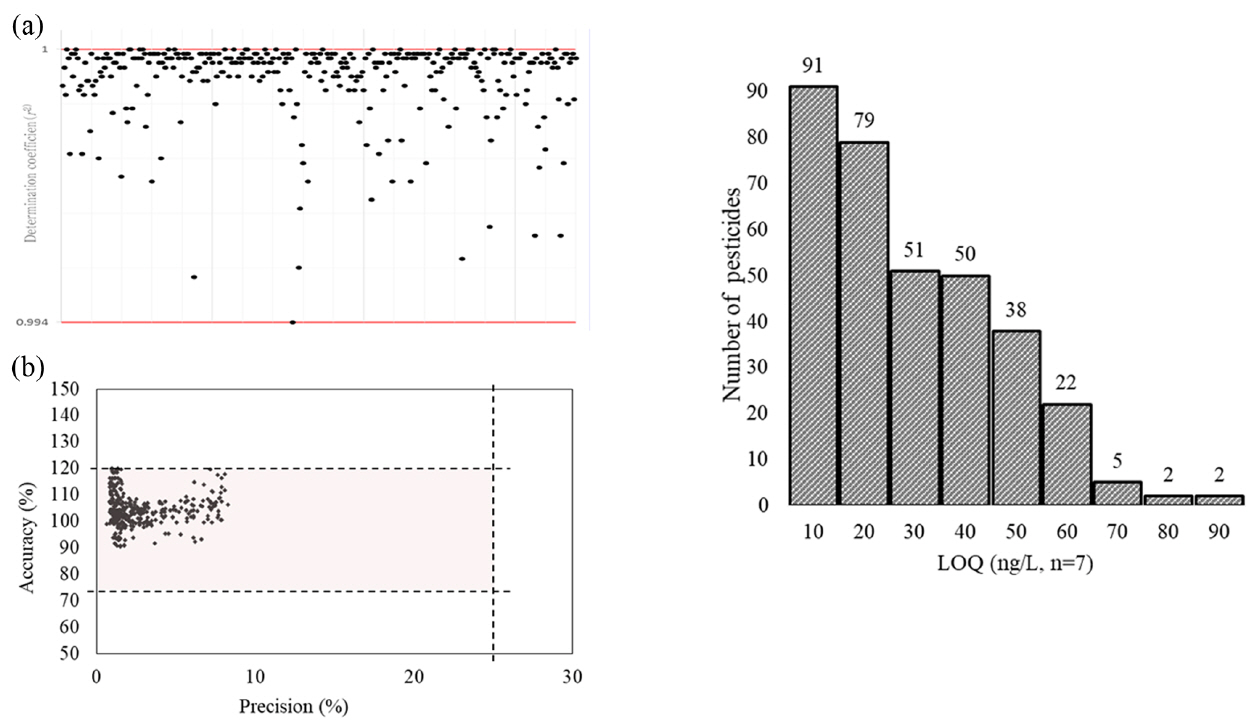
Method validation of 340 pesticides with the Online-SPE-LC-Orbitrap/HRMS: (A) calibration curve (B) accuracy (%) and precision (%) (n=5) (C) LOQ range(n=7).
4. 결 론
본 연구에서는 수질시료에 적합한 온라인 고체상 추출장비와 다성분 분석에 적합한 LC-Orbitrap질량분석기를 활용하여 수질환경 기준 및 먹는물 수질기준에 포함되지 않지만, 국민의 건강에 위협이 될 수 있는 360종의 농약류(제초제, 살균제, 살충제 등)의 다성분 동시 분석 및 적용성을 평가하였다. LC로 검출이 안되는 항목이나 피크중복 항목(Norfloxacin, TCMTB 등 20항목) 이외 340항목의 분리는 잘 이루어졌으며, 연구에서 확립한 온라인 고체상 추출방법 및 분석시스템의 대한 유효성 검증결과 상관계수(r2)는 0.994이상, 방법검출한계와 정량한계는 각각 1.64~88.95 ng/L, 5.23~283.29 ng/L,ᅠ정확도는 91~120%으로 75~120%를 만족하였으며, 정밀도는 0.63~8.21%로 25%이하를 만족하여 모두 양호한 결과가 도출되었고, 이는 수질중의 농약류의 모니터링에 충분히 적용 가능할 것으로 판단된다. 머무름 시간이 중복되어 조각화가 이루어지지 못한 항목들에 관해서는 추가적인 연구가 필요하다고 생각한다. 본 실험법은 전처리시 2~3시간 이상 소요되는 0.5~1 L의 많은 시료가 필요한 공정시험방법에 비해 1 mL의 적은 시료 양으로 농축컬럼을 통해 3분이내로 전처리를 할 수 있는 온라인고상추출법을 사용하여 전처리 및 기기분석시간을 단축시켰으며, 이는 추후 환경오염 사고시 신속하게 분석 가능할 것으로 판단된다.
Acknowledgements
이 연구는 국립환경과학원 Research R&D지원으로 수행되었습니다(NIER20190101058).