주거환경 중 다환방향족탄화수소(PAHs) 분석방법 제시를 위한 연구
A study on Polycyclic Aromatic Hydrocarbons Analysis Presented in the Residential Environment
Article information
Trans Abstract
In this study, methods of extraction, purification, and instrumental analysis are validated for 16 types of polycyclic aromatic hydrocarbons (PAHs) defined by the United States Environmental Protection Agency (US EPA), to analyze their occurrence during cooking in residential environments. Accelerated solvent extraction (ASE), which is more efficient than other extraction methods, are used and the recovery rate of gaseous samples (excluding NaP) and particulate samples was 80-110% with a relative standard deviation (RSD) of 0.6-19.8%. The purification method was compared with the column and the cartridge purification, with recovery rates of 80-110% and 60-100%, respectively. Through this process, a high recovery rate of the 16 substances was confirmed by the column purification method after ASE. The rate was 78-102% (RSD: 0.3-10%) for the gas samples and 73.7-101.7% (RSD: 0.7-20%) for particulate samples, respectively. The recovery rate of the analytical method used in this study was 66.6-80.2% (RSD: 4.7-8.3%) in the gas phase samples and 72.5-97% (RSD: 5.1-10.1%) in the particulate samples. As a result, it seems reasonable to apply the analytical method proposed in this study to real sample analyses.
1. 서 론
현 시대에 들어오면서 실외에서 생활하는 시간보다 안정적인 실내공간에서 생활하는 시간이 증가하였고, 이로 인해 하루 중 주요 생활공간은 실외가 아닌 실내로 이동 하였다. 세계보건기구(WHO)의 자료에 의하면 지구 전체 건물 중 약 30%는 실내공기에 인한 건강위험이 최고 5배까지 높다고 보고하였다[1]. 양원호 등의 연구책임자에 따르면, 한국인을 대상으로 실시한 일일 평균 시간활동 조사결과 주택에서 14.23시간(59.3%), 기타(학교, 직장 등) 6.8시간(28.3%), 이동 1.75시간(7.3%), 실외 1.26시간(5.2%)생활한다고 보고하였다[2]. 위와 같이 실내, 특히 주택에서 생활하는 시간이 많음에 따라 주택에서의 실내공기질 관리의 중요성이 대두되고 있다. 기존 실내공기질 연구의 초점은 사무실 및 공공기관에 한정되었으나 최근에는 신축 공동주택에 대한 실내공기질 관리법이 시행 됨에 따라서 포름알데히드와 VOC에 관한 연구가 많이 진행되고 있다[3]. 그 외 Radon, 석면, 미세먼지 등 실내공기오염물질을 선정하여 실내공기질 공정시험기준[4]에 규정 및 규제를 마련하여 관리하고 있으나, 다환방향족탄화수소(Polycyclic Aromatic Hydrocarbons, PAHs)는 실내공기질 관리법 및 실내공기질 공정시험기준에서 제시되지 않고 있다. 또한, 국외 실내공기질 관리 기준에서도 제시되지 않고 있다[18]. PAHs는 2개 이상의 벤젠고리가 융합된 유기화합물을 총칭으로, 발암등급 1로 분류된 Benzo(a) pyrene 및 naphthalene, chrysene, benzo(k)fluoranthene, dibenz (a,h) anthracene, indeno(1,2,3-cd)pyrene, benzo(b) fluoranthene, benzo(a)anthracene은 발암 가능성이 있는 물질 2B 이상으로 구분하여 관리하고 있다[19,20]. PAHs는 주로 열을 이용한 연소과정에서 발생하며, 대부분 입자상으로 존재하나 PAHs 화합물의 분자량과 주변의 공기의 온도에 따라 부분적으로 기체상으로 존재한다.
PAHs의 위험성은 이미 잘 알려져 있는데, 그 중 국립암센터에서 따르면, PAHs에 의한 한국인의 암 발생률은 1999년 기준으로 매년 증가하는 추세로, 그 중 폐암의 발생률은 갑상선, 위, 대장 다음으로 4위이지만, 사망률로 보면 2012년 기준으로 1위는 폐암인 것으로 발표되었다[2,5,6]. 폐암의 주요 원인은 흡연으로 알려 졌지만, 2010년 기준 우리나라 남성의 흡연율은 48.3%, 여성의 흡연율은 6.3%를 차지하였으나[7] 여성의 전체 폐암환자 중 79%가 비흡연자이다[8]. 그 원인으로 음식 조리시에 발생하는 연소물이 호흡기 질환과 폐암에 영향을 미치는 것으로 밝혀졌다[9]. 주거에서 불을 이용한 음식 조리 시 유해물질이 배출되어 인체에 영향을 미치는 것으로 보고되었으며[10], 조리시 환기부족으로 매년 2백만명 이상 사망이 추정된다는 WHO의 연구결과[1]에 따라 실내 공간에서 PAHs 발생 연구에 대한 필요성을 확인할 수 있다. 실제 주택에서 PAHs 발생분포를 보면 방>주방>거실>발코니 순으로 확인 되는데[11] 이러한 위험성을 감지하면서도 우리나라에서는 실내공간을 대상으로 실시한 PAHs 연구의 수는 현재 매우 부족한 상황이다[12]. 이는 여러 연구기관이나 연구자에 의해 PAHs 노출이나[12], 다중이용 시설 내 농도 분포 특성에 대해서는 연구 결과[17]등은 발표 됐으나, 실내공기 중 PAHs 분석방법에 대한 연구가 미흡하다. 특히, 분석방법의 적립에 기초적인 추출 방법 효율성, 표준시료에 의한 회수율 등에 대한 비교 자료는 현재 전무한 실정이다. 따라서 본 연구에서 주거환경 중 PAHs 분석을 간단하고 효율적으로 실시하기 위한 방법을 마련하고, 또한 분석방법의 신뢰성을 확보하기 위하여 QA/QC요소인 회수율, 상대표준편차, 정량한계, 검출한계, 재현성을 확인하였다.
2. 실험방법
2.1 표준용액 및 시약
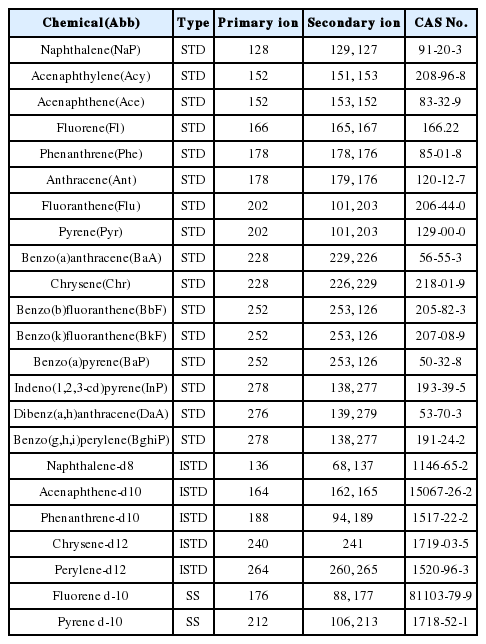
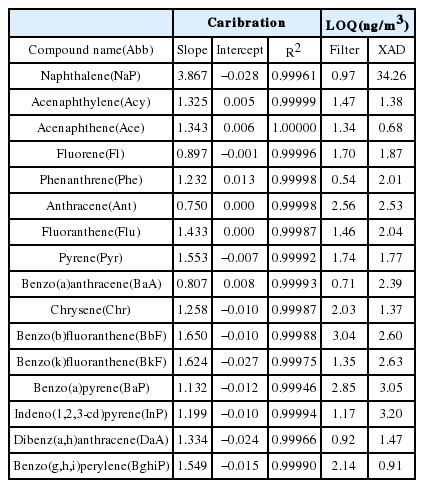
실내공기 중 PAHs 분석방법에 대한 정밀·정확도를 검토하기 위하여 PAHs 표준용액을 사용하였다. 표준용액은 Polynuclear Aromatic Hydrocarbons (Accustandard, USA) 혼합액을 사용하였다. 확인하고자 하는 물질은 대기오염공정시험기준 ES 01505.1 [13] 및 US EPA(미국환경청)에서 지정한 우선관리대상물질인 16종이다. 16종의 다성분 분석을 위해 GC/MS를 이용하였으며, 기기적 감응을 고려하여 내부표준법을 이용하였다. 내부표준법에 사용된 표준물질 혼합액 (Chemservice, USA)은 Naphthalene-d8, Acenaphthene-d10, Phenanthrene-d10, Chrysene-d12, Perylene-d12으로 균일한 양을 시료에 주입하였다. 또한, 전처리 단계인 추출과 정제에 이르기까지 시험방법의 효율을 검토하기 위하여 Fluorene d-10과 Pyrene d-10을 대체표준물질을 사용하였다. 각 물질의 자세한 정보는 Table 1에 나타내었다.
2.2 시료채취 방법
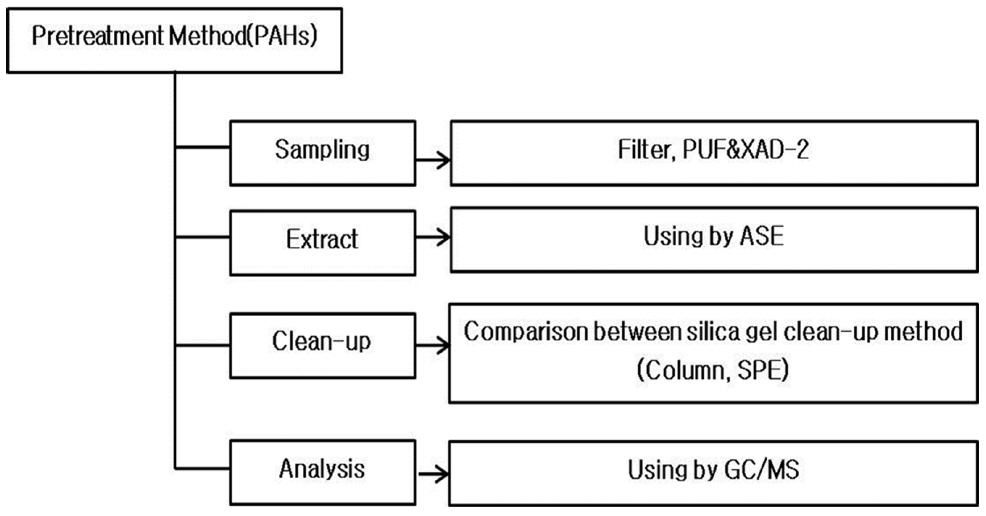
시료는 입자상 물질과 가스상 물질로 구분 하여 시료채취를 하였으며, 입자상 물질을 채취하기 위한 Filter (Whatman, 47 mm)는 500°C에서 16시간 이상 항량 하였고, 가스상 물질을 채취하기 위하여 XAD-2와(Supelco, USA) PUF(Puf material, Used in URG-2000-30PUF)를 사용 하였다. XAD-2는 Dichloromethane(DCM)(Wako, Japan)으로 24시간 속슬렛 추출을 하였으며, PUF는 Acetone(Wako, Japan)으로 24시간 속슬렛 추출을 하여 잔존되어 있는 유기물을 제거하여 PUF 사이에 XAD-2 수지를 충진(약 5g) 후 사용 하였다. 시료샘플유량은 10 L/min으로 60분간 총 600 L를 포집하였다(Fig. 1).
2.3 전처리방법
본 연구에서는 PAHs를 입자상과 가스상으로 구분하여 채취하였다. 입자상은 Filter를 이용하였으며, 가스상은 PUF를 이용하였다. 입자상과 기체상으로 채취된 필터와 PUF는 ASE를 이용하여 추출하였다. 필터에 채취된 입자상 물질은 ASE cell 10 mL에 담고 무수황산나트륨을 넣어 공극을 최소화 하였다. PUF에 흡착된 PAHs의 물질을 추출하기 위해서 ASE cell에 무수황산나트륨을 넣고 PUF를 30 mL cell에 담아 추출하였다. ASE cell에 대체표준물질을 넣어 전처리 과정에서의 회수율을 검토하고자 하였다.
정제방법은 실리카겔 정제방법 중 컬럼정제와 카트리지 정제 비교 실험을 수행 하여 내부표준물질을 첨가하여 최종 1 mL로 맞추어 기기 분석하였다. 기기분석은 가스크로마토그램 질량분석기(GC/MS)를 사용 하였으며, 전처리 방법을 도식화 하여 다음의 그림으로 나타냈다(Fig. 2).
2.3.1 가속용매추출
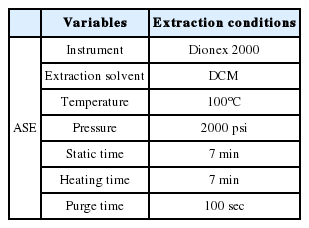
PAHs 추출 방법으로는 초음파 추출, 마이크로웨이브 추출, 속슬렛 추출, 열탈착 방법 등이 있으나, 본 실험에서는 가속용매추출기(Accelerated Solvent Extractor, ASE)는 Dionex(Dionex 200, USA)을 사용하였다. ASE 추출방법의 장점으로 타 추출방법 대비 사용용매의 양이 적으며, 빠른 추출시간 및 효율성을 얻을 수 있다[14]. 추출에 사용된 용매는 DCM이며 고압 2000 psi, 고온 100°C로 추출하였다. 자세한 추출 조건은 다음 Table 2와 같다.
2.3.2 컬럼정제
컬럼정제 방법은 US EPA Method 3630C [15]에 있는 정제방법을 사용 하였다. 실리카겔(70~230 mesh, Merck)은 오븐에서 130°C에서 16시간 이상 구운 것을 사용 하였고, 실리카겔 10 g을 DCM을 이용하여 슬러리 상태로 만든 후 정제컬럼(OD:28 mm, Length:137 mm)을 만들었다. 기포가 생기지 않게 만들어진 실리카겔 컬럼에 정제에 사용되는 용매를 이용하여 활성화 시킨 후 Pentane(JT, Canada) 40 mL와 DCM과 Pentane 혼합액(V/V = 4:6)30 mL을 순차적으로 주입하여 2 mL/min 속도로 흐르게 하였다. 준비된 실리카겔 컬럼에 16종의 PAHs 표준물질 및 대체표준물질을 첨가하여 정밀 · 정확도를 확인하였다. 이때 사용된 농도는 저농도 및 고농도로 각각 20 pg, 100 pg이 되도록 주입하였다.
2.3.3 카트리지(SPE) 정제
카트리지는 Agilent 사의 Bond Elut(HF Mega BE-SI 5 g, 20 ml)을 사용 하였다. 카트리지를 이용한 정제방법은 확립되어 있지 않기 때문에 EPA Method 3630C의 컬럼정제 방법을 기반으로 조건을 확립하고자 하였다. 용매의 혼합비율 및 용출의 양을 지정하기 위해 극성 비율에 따른 회수율과 용출의 양에 따른 회수율을 비교하였다.
3. 결 과
3.1 ASE(Accelerated Solvent Extractor) 추출에 따른 회수율
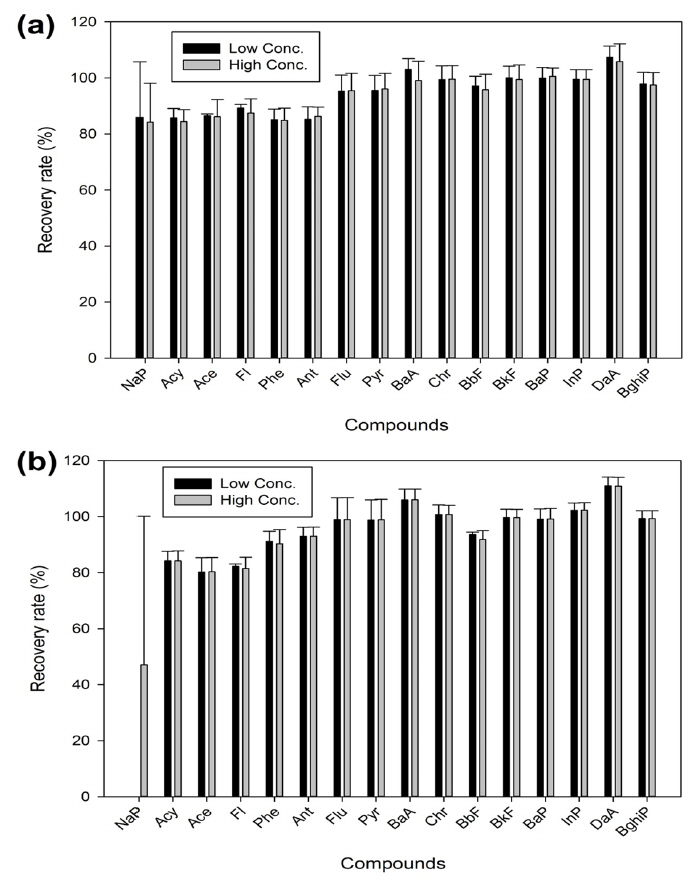
ASE에 대하여 정밀 정확도를 검토하기 위해 Filter와 PUF&XAD-2에 표준농도를 주입하여 추출 후 회수율을 확인하였다. 주입된 표준용액은 저농도 20 pg, 고농도 100 pg가 포함되어 추출하였다(Fig. 3). 입자상 채취에 사용되는 Filter의 경우 저 · 고농도를 주입한 결과 80%이상의 회수율을 나타냈다. 또한 3반복 측정 결과 상대표준편차는 NaP을 제외하고 0.5~7.8%로 우수한 신뢰도를 보였다. NaP의 경우 상대표준편차가 저 · 고농도에서 각각 19.82%, 13.89%로 벤젠고리가 두 개인 NaP의 Semi-VOCs 성향이 강한 특성으로 인해 상대적인 오차율이 크게 나타난 것으로 사료된다. XAD-2와 PUF의 경우 NaP을 제외하고 저·고농도에서 회수율 80% 이상, 상대표준편차 2.7~7.9%의 결과를 나타냈다. 하지만 NaP의 경우 저농도에서는 검출되지 않았는데, 본 연구결과 NaP의 정량한계는 저농도 주입량보다 높은 34.26 pg으로 확인 되었고, 고농도에서는 NaP는 회수율 47.1% 상대표준편차는 35.06%으로 편차가 심한 결과를 보였다.
3.2 실리카겔 정제방법에 따른 회수율
정제방법에는 컬럼정제와 SPE 정제 방법이 있다. 대기오염공정시험기준에는 컬럼정제를 제시하였으나 간단한 SPE 정제방법을 검토함으로써 상호간 정제효율을 비교하였다. EPA Method 3630C(Silica gel clean up)을 참고하여 간단한 SPE 정제방법을 검토함으로써 상호 간 정제효율 비교하였다.
3.2.1 컬럼정제
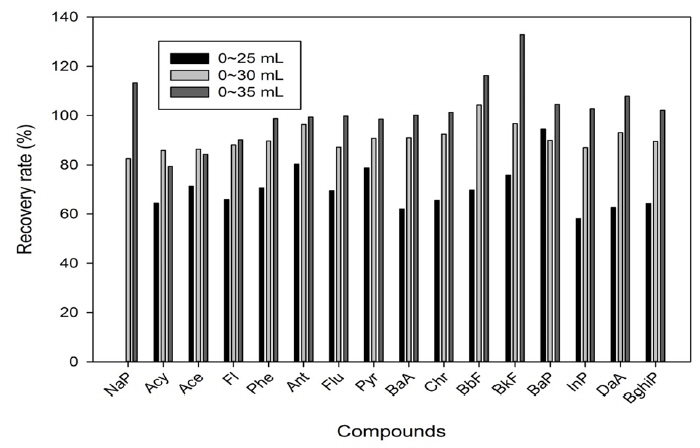
컬럼정제의 안정적인 범위를 찾고자 용출의 양에 따른 회수율을 비교하였다. EPA Method 3630C에는 용출혼합액(DCM:Pentane(V:V=2:3))을 이용하여 25 mL 주입을 제시하였으나 본 연구에서는 25 mL, 30 mL, 35 mL로 실험하였다. 그 결과 16종의 Total PAHs 회수율은 25 mL, 30 mL, 35 mL에 각각 66%, 91%, 101%로 나타났다. 물질 별 회수율을 확인한 결과 25 mL 주입 시 NaP은 회수되지 않았으며, 35 mL 주입 시 BkF은 회수율이 120% 넘게 나타나는 등의 전반적인 과대평가되었다. 하지만 30 mL 주입 시 회수율은 82.5~104.3%까지 고르게 검출됨을 확인 할 수 있었다. 따라서 본 연구에서는 시간 및 용매 사용량을 고려하여 용출 액은 30 mL로 하였다(Fig. 4).
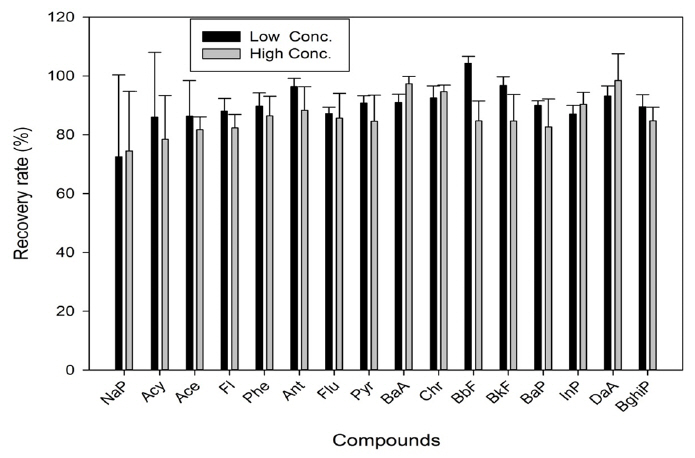
정립된 컬럼정제 방법으로 저·고농도의 회수율 실험한 결과 각 물질 별 80%이상의 회수가 되었다. 이는 US EPA TO-13A [16] 에서 제시한 60~120% 회수율 범위 및 USEPA Method 810020)에서 제안한 회수율 범위(60~120%)를 충족하고 있으며, 다중이용 시설 내에서 PAHs 연구 분석한 논문[17]에서 도출 한 회수율 실험 결과(PUF : 60.7~127.2%, Filter : 77.6~132.5%)와 비교 시 본 연구에서도 PAHs 16종 물질이 저 · 고농도에서 80~110%로 우수한 결과를 보였다. Fig. 5에서 저 고농도 회수율 결과를 나타내었다.
3.2.2 카트리지(SPE) 정제
SPE(Solid Phase Extraction) 카트리지를 이용하여 시간 및 사용 용매를 줄이는 간단한 정제방법을 검토하였다. 다성분 물질이 포함되어 있는 경우 정제시 용출액의 특성에 따라 회수율이 다르게 나타난다. 따라서 정제방법간 비교실험으로 흡착에 영향을 줄 수 있는 극성 정도에 변수를 주어 혼합액 비율은 각각 DCM : Pentane(V:V=2:3), (V:V=1:1), (V:V=3:2)로 정제하였다. 각각의 그룹에 대해 10 mL 씩 4번 용출하는 연속 식 실험방법을 사용하여 주입량 별로 효율을 검토 하였다(Fig. 6).
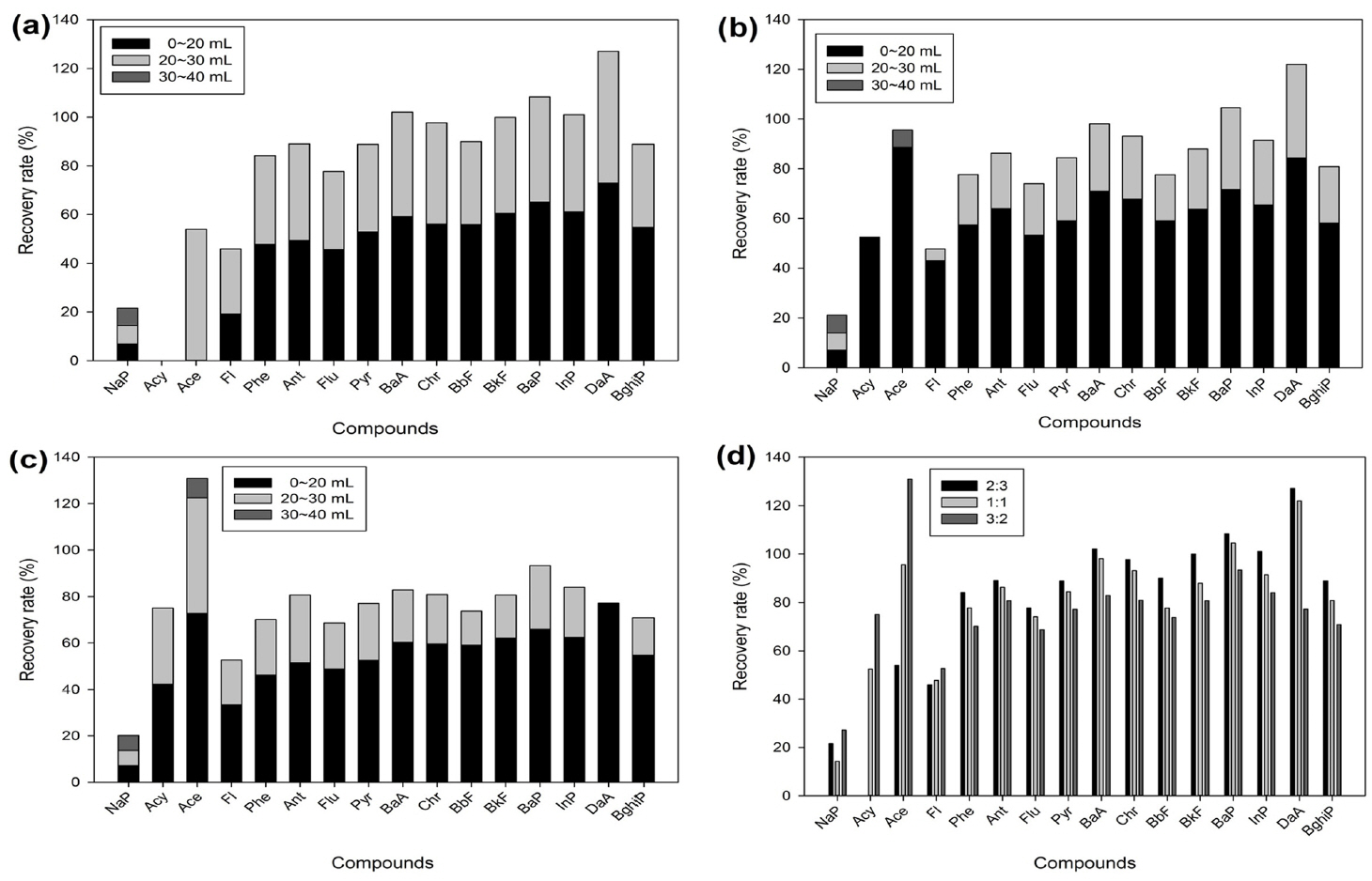
Recovery rates by combined polarities (DCM : pentane). (a) (V:V=2:3), (b) (V:V=5:5), (c) (V:V=3:2), (d) Total
그 결과 혼합액 2:3 에서 Acy는 회수되지 않았으나, 3:2에서는 75.05% 회수율을 보였다. 또한 Ace는 2:3에서 30 mL 이상의 용출시켰을 때 53.95% 반면 1:1에서는 20 mL 용출 시 88.55%의 회수율을 보였다. 이는 용매의 극성 차이에 따라 물질 별 추출되는 속도 및 회수에 영향을 미치는 것을 알 수 있다. 본 연구에서는 용매 시간과 회수율을 비교하여 우수한 DCM : Pentane (V:V=1:1) 비율로 용매 사용량을 검토 실험을 진행하였다. 용출에 사용되는 용매 사용량은 컬럼정제 방법과 동일한 25 mL, 30 mL, 35 mL로 나누어 실험하였다. 그 결과 Total PAHs에서는 80~86% 이상의 회수율을 보였으며, 벤젠고리 4~6개 이상의 물질에 대해서는 60~100% 회수율을 보였다(Fig. 7). 하지만 벤젠고리 3개 이하인 물질에 대해서는 낮은 회수율 및 과대평가 되는 등의 결과가 나타났다. 따라서 SPE 정제 방법은 혼합액 30 mL 주입 시 PAHs 16종 물질에 대한 주입량 별 회수율 시험 결과 비교적 고른 회수율을 얻을 수 있었다.
3.3 주거환경 중 PAHs 분석법 확립
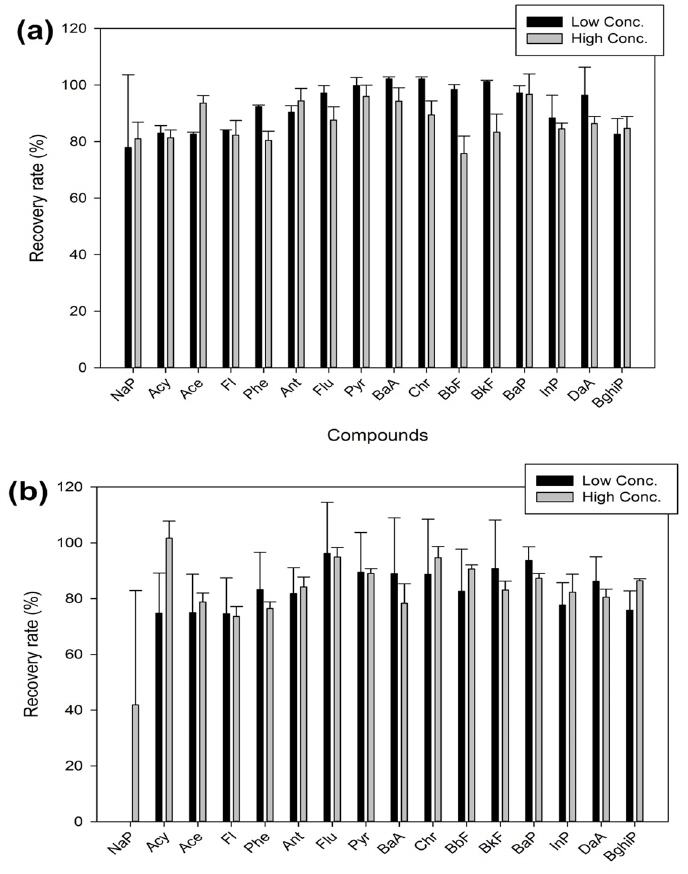
ASE 추출을 통해 컬럼정제를 사용하여 분석방법의 정밀 · 정확도를 검토하였다. 입자상 오염물질을 채취하는 Filter를 이용하여 PAHs 16종을 저농도 20 pg, 고농도 100 pg 넣고 추출 및 정제를 진행하였다. 기기분석 결과 저농도와 고농도에서 각각 78~102%, 81~96%의 회수율을 보였다. 상대표준편차는 저농도에서 NaP (RSD:25%)을 제외하고 0.3~9.95%, 고농도에서는 2.0~7.3%의 정밀도를 나타냈다. NaP의 경우 앞서 실험한 추출에서도 19%의 높은 수치를 나타내었는데, 저농도에서는 정제의 실험단계를 걸치면서 상대표준편차가 높아 진 것으로 사료된다. 하지만 고농도에서는 높은 정확도 및 정밀도를 나타냈다.
PUF&XAD-2를 이용하여 PAHs 16종을 저농도 20 pg, 고농도 100 pg 넣고 입자상 오염물질 분석 방법과 동일하게 진행하였다. 그 결과 NaP를 제외하고 저농도와 고농도에서 각각 74.57~96.13%, 73.7~101.7%를 나타냈다. 상대표준편차는 저농도 6.93~19.99%, 고농도 0.7~7.0% 수치를 보였다. NaP는 저농도에서 정량한계 미만으로 불검출 되었으며, 고농도에서는 41.9%, 상대표준편차는 40.95%를 보였다. PUF의 경우 벤젠고리 2개인 NaP, Acy, Ace 등은 USEPA에서 제시한 회수율 범위는 35% 이하지만(USEPA, TO-13A), 본 연구에서는 Acy, Ace 물질이 75%가 넘는 우수한 결과를 나타냈다. 이는 XAD-2를 이용한 경우 PUF를 이용한 것보다 우수한 포집 및 회수율을 보이기 때문으로 사료된다. 다음의 Fig. 8은 ASE를 이용한 추출과 컬럼정제방법을 사용하여 회수율을 이용하여 정밀· 정확도를 나타낸 것이다.
3.4 육류 및 어류 조리시 실내공기 중 PAHs 채취 및 분석 결과
주방에서 육류 및 어류를 이용하여 조리 시 발생되는 PAHs를 채취하여 정립된 실험 방법을 실제 시료에 적용 하였다. 조리방법은 굽는 방법을 사용하였으며, 육류는 1시간에 6회(약 380 g/회), 어류는 1시간에 8회(약 350 g/회)를 사용하였다. 시료채취는 주방에서 빈번히 사용되는 기름을 이용하여 가스연소 시 발생되는 PAHs를 채취하였다. 시료 분석 시 실험실 바탕시료, 현장 바탕 시료를 추가하였으며, 실험실 및 현장 바탕시료에서 오염되지 않았음을 확인하였다. 또한 검출 할 수 있는 정량한계를 구하였다(Table 4).
시험방법의 효율을 모니터 하기 위하여 추출 및 정제에 이르기 까지 전반적인 과정을 검토할 수 있게 대체표준물질을 첨가하였다. 대체표준물질 Fluorene-d10은 2~3개의 벤젠고리를 포함한 물질을, Pyrene-d10은 4~5개의 벤젠고리를 포함한 물질을 모니터링 하는 것으로 구분 하였다. 분석 결과 Fluorene-d10의 회수율은 입자상과 가스상에서 각각 72.48%(RSD:10.09%), 66.60% (RSD:8.31%)로 나타났다. Pyrene-d10의 회수율은 입자상과 가스상에서 각각 96.77%(RSD:5.07%), 80.20% (RSD:4.70%)로 나타났다(Table 5). 벤젠고리 2~3개로 구성된 물질은 회수율이 상대적으로 낮게 나왔으나 65% 이상의 회수율과 10% 내외의 상대표준편차를 보여 EPA TO-13A에서 제시한 값보다 우수하였다.
4. 결 론
본 연구에서 주거환경에서 조리 중에 발생되는 PAHs 분석방법을 제시하고자 하였으며, 추출은 간단하고 비용 저감이 가능한 ASE를 이용하였다. 그 결과 Filter에서 저·고농도에서 80~106%의 회수율을 확인 하였으며, PUF&XAD-2에서는 NaP를 제외한 15종 물질에 대해 80~110%의 회수율을 보였다. 정제 단계에서는 컬럼과 카트리지를 이용하여 비교 검토하였다. 컬럼정제는 Filter와 PUF&XAD-2 모두 우수한 결과를 보였으나, 카트리지 정제의 경우 벤젠고리 2~3개와 3~4개의 물질에 대한 회수율 시험 결과 편차가 높음을 알 수 있었다. ASE를 이용한 추출과 컬럼정제를 선택하여 실내공기질 중 PAHs 분석법을 확립하여 적용 가능성을 검토하고자 실제 시료 채취 후 분석 하였다. 표준물질을 이용하여 확인한 결과 Filter 및 PUF&XAD-2에서 벤젠고리 2~3개(가스상 매질에서 NaP 제외) 물질은 65% 이상의 정확도와 10% 이하의 정밀도를 나타냈으며, 벤젠고리 4~5개 물질은 80% 이상의 정확도와 5% 이하의 정밀도를 나타냈다. 대체표준물질인 Fluorene-d10(벤젠고리 2~3개), Pyrene-d10(벤젠고리 3~4개)를 이용하여 회수율 및 상대표준편차를 확인 한 결과 벤젠고리 3~4개의 물질에 대해서는 회수율(Filter:96.77%, PUF&XAD-2:80.2%), 상대표준편차(Filter: 5.07%, PUF&XAD-2:4.7%)의 결과를 확인 하였다. 벤젠고리 2~3개의 물질에 대해서는 대기오염공정시험기준 ES 01051.1 및 US EPA의 기준을 충족은 시켰으나 벤젠고리 수가 많은 물질에 비해 낮은 결과를 확인 하였는데, 이는 PUF& XAD-2에서 검출되지 않은 NaP와 함께 추후 시험조건 변경을 통한 추가연구가 필요할 것으로 판단된다.
Acknowledgements
본 논문은 환경부의 재원으로 국립환경과학원의 지원을 받아 수행하였습니다.(NIER-2018-01-01-064)